 |
Главная |
Соединения без внешней сферы
|
из
5.00
|
Дисперсные системы
Комплексные соединения
Чистые вещества в природе встречаются очень редко. Смеси разных веществ в различных агрегатных состояниях могут образовывать гетерогенные и гомогенные системы — дисперсные системы и растворы.
Дисперсными называют гетерогенные системы, в которых одно вещество в виде очень мелких частиц равномерно распределено в объеме другого.
То вещество, которое присутствует в меньшем количестве и распределено в объеме другого, называют дисперсной фазой. Она может состоять из нескольких веществ.
Вещество, присутствующее в большем количестве, в объеме которого распределена дисперсная фаза, называют дисперсионной средой. Между ней и частицами дисперсной фазы существует поверхность раздела, поэтому дисперсные системы называют гетерогенными (неоднородными).
И дисперсионную среду, и дисперсную фазу могут представлять вещества, находящиеся в различных агрегатных состояниях — твердом, жидком и газообразном.
В зависимости от сочетания агрегатного состояния дисперсионной среды и дисперсной фазы можно выделить 9 видов таких систем.
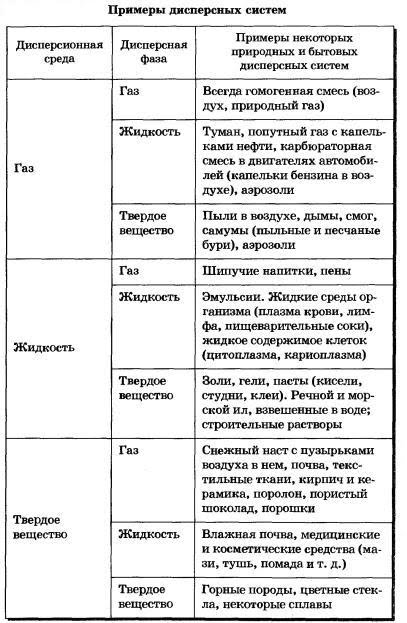
По величине частиц веществ, составляющих дисперсную фазу, дисперсные системы делят на грубодисперсные (взвеси) с размерами частиц более 100 нм и тонкодисперсные (коллоидные растворы или коллоидные системы) с размерами частиц от 100 до 1 нм. Если же вещество раздроблено до молекул или ионов размером менее 1 нм, образуется гомогенная система — раствор. Она однородна (гомогенна), поверхности раздела между частицами и средой нет.
Уже беглое знакомство с дисперсными системами и растворами показывает, насколько они важны в повседневной жизни и в природе.
Судите сами: без нильского ила не состоялась бы великая цивилизация Древнего Египта; без воды, воздуха, горных пород и минералов вообще бы не существовала живая планета — наш общий дом — Земля; без клеток не было бы живых организмов и т. д.
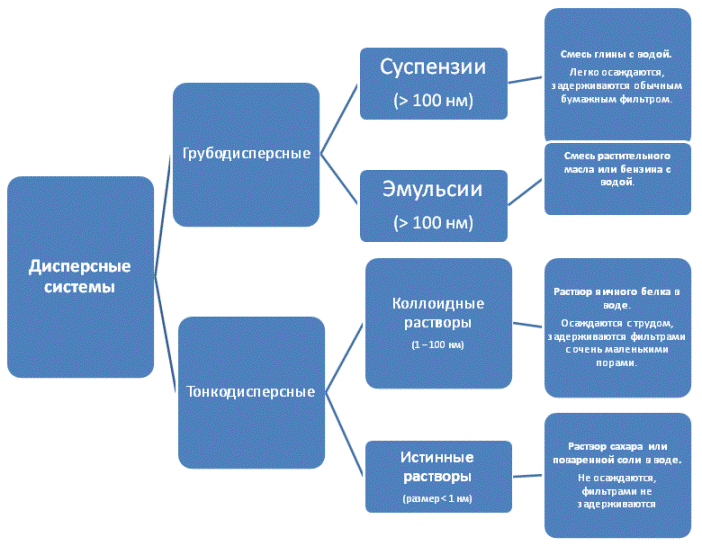
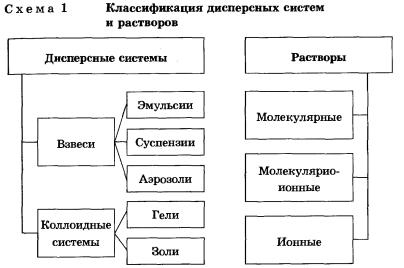
Классификация дисперсных систем и растворов
Взвеси
Взвеси — это дисперсные системы, в которых размер частиц фазы более 100 нм. Это непрозрачные системы, отдельные частицы которых можно заметить невооруженным глазом. Дисперсная фаза и дисперсионная среда легко разделяются отстаиванием. Такие системы разделяют на:
1) эмульсии (и среда, и фаза — нерастворимые друг в друге жидкости). Это хорошо известные вам молоко, лимфа, водоэмульсионные краски и т. д.;
2) суспензии (среда — жидкость, а фаза — нерастворимое в ней твердое вещество). Это строительные растворы (например, «известковое молоко» для побелки), взвешенный в воде речной и морской ил, живая взвесь микроскопических живых организмов в морской воде — планктон, которым питаются гиганты-киты, и т. д.;
3) аэрозоли — взвеси в газе (например, в воздухе) мелких частиц жидкостей или твердых веществ. Различают пыли, дымы, туманы. Первые два вида аэрозолей представляют собой взвеси твердых частиц в газе (более крупные частицы в пылях), последний — взвесь мелких капелек жидкости в газе. Например, природные аэрозоли: туман, грозовые тучи — взвесь в воздухе капелек воды, дым — мелких твердых частиц. А смог, висящий над крупнейшими городами мира, также аэрозоль с твердой и жидкой дисперсной фазой. Жители населенных пунктов вблизи цементных заводов страдают от всегда висящей в воздухе тончайшей цементной пыли, образующейся при размоле цементного сырья и продукта его обжига — клинкера. Аналогичные вредные аэрозоли — пыли — имеются и в городах с металлургическими производствами. Дым заводских труб, смоги, мельчайшие капельки слюны, вылетающие изо рта больного гриппом, также вредные аэрозоли.
Аэрозоли играют важную роль в природе, быту и производственной деятельности человека. Скопления облаков, обработка полей химикатами, нанесение лакокрасочных покрытий при помощи пульверизатора, распыление топлив, выработка сухих молочных продуктов, лечение дыхательных путей (ингаляция) — примеры тех явлений и процессов, где аэрозоли приносят пользу. Аэрозоли — туманы над морским прибоем, вблизи водопадов и фонтанов, возникающая в них радуга доставляет человеку радость, эстетическое удовольствие.
Для химии наибольшее значение имеют дисперсные системы, в которых средой является вода и жидкие растворы.
Природная вода всегда содержит растворенные вещества. Природные водные растворы участвуют в процессах почвообразования и снабжают растения питательными веществами. Сложные процессы жизнедеятельности, происходящие в организмах человека и животных, также протекают в растворах. Многие технологические процессы в химической и других отраслях промышленности, например получение кислот, металлов, бумаги, соды, удобрений, протекают в растворах.
Коллоидные системы
Коллоидные системы — это такие дисперсные системы, в которых размер частиц фазы от 100 до 1 нм. Эти частицы не видны невооруженным глазом, и дисперсная фаза и дисперсионная среда в таких системах отстаиванием разделяются с трудом.
Их подразделяют на золи (коллоидные растворы) и гели (студни).
1. Коллоидные растворы, или золи. Это большинство жидкостей живой клетки (цитоплазма, ядерный сок — кариоплазма, содержимое органоидов и вакуолей) и живого организма в целом (кровь, лимфа, тканевая жидкость, пищеварительные соки, гуморальные жидкости и т. д.). Такие системы образуют клеи, крахмал, белки, некоторые полимеры.
Коллоидные растворы могут быть получены в результате химических реакций; например, при взаимодействии растворов силикатов калия или натрия («растворимого стекла») с растворами кислот образуется коллоидный раствор кремниевой кислоты. Золь образуется и при гидролизе хлорида железа (Ш) в горячей воде. Коллоидные растворы внешне похожи на истинные растворы. Их отличают от последних по образующейся «светящейся дорожке» — конусу при пропускании через них луча света.
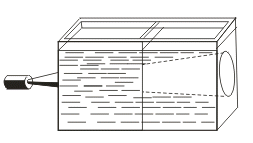
Это явление называют эффектом Тиндаля. Более крупные, чем в истинном растворе, частицы дисперсной фазы золя отражают свет от своей поверхности, и наблюдатель видит в сосуде с коллоидным раствором светящийся конус. В истинном растворе он не образуется. Аналогичный эффект, но только для аэрозольного, а не жидкого коллоида, вы можете наблюдать в кинотеатрах при прохождении луча света от киноаппарата через воздух кинозала.
Частицы дисперсной фазы коллоидных растворов нередко не оседают даже при длительном хранении из-за непрерывных соударений с молекулами растворителя за счет теплового движения. Они не слипаются и при сближении друг с другом из-за наличия на их поверхности одноименных электрических зарядов. Но при определенных условиях может происходить процесс коагуляции.
Коагуляция— явление слипания коллоидных частиц и выпадения их в осадок — наблюдается при нейтрализации зарядов этих частиц, когда в коллоидный раствор добавляют электролит. При этом раствор превращается в суспензию или гель. Некоторые органические коллоиды коагулируют при нагревании (клей, яичный белок) или при изменении кислотно-щелочной среды раствора.
2. Гели, или студни, представляющие собой студенистые осадки, образующиеся при коагуляции золей. К ним относят большое количество полимерных гелей, столь хорошо известные вам кондитерские, косметические и медицинские гели (желатин, холодец, желе, мармелад, торт «Птичье молоко») и конечно же бесконечное множество природных гелей: минералы (опал), тела медуз, хрящи, сухожилия, волосы, мышечная и нервная ткани и т. д. Историю развития жизни на Земле можно одновременно считать историей эволюции коллоидного состояния вещества. Со временем структура гелей нарушается — из них выделяется вода. Это явление называют синерезисом.
Растворы
Раствором называют гомогенную систему, состоящую из двух и более веществ.
Растворы всегда однофазны, то есть представляют собой однородный газ, жидкость или твердое вещество. Это связано с тем, что одно из веществ распределено в массе другого в виде молекул, атомов или ионов (размер частиц менее 1 нм).
Растворы называют истинными, если требуется подчеркнуть их отличие от коллоидных растворов.
Растворителем считают то вещество, агрегатное состояние которого не изменяется при образовании раствора. Например, вода в водных растворах поваренной соли, сахара, углекислого газа. Если же раствор образовался при смешении газа с газом, жидкости с жидкостью и твердого вещества с твердым, растворителем считают тот компонент, которого больше в растворе. Так, воздух — это раствор кислорода, благородных газов, углекислого газа в азоте (растворитель). Столовый уксус, в котором содержится от 5 до 9% уксусной кислоты, представляет собой раствор этой кислоты в воде (растворитель — вода). Но в уксусной эссенции роль растворителя играет уксусная кислота, так как ее массовая доля составляет 70— 80%, следовательно, это раствор воды в уксусной кислоте.
При кристаллизации жидкого сплава серебра и золота можно получить твердые растворы разного состава.
Растворы подразделяют на:
• молекулярные — это водные растворы неэлектролитов — органических веществ (спирта, глюкозы, сахарозы и т. д.);
• молекулярно-ионные — это растворы слабых электролитов (азотистой, сероводородной кислот и др.);
• ионные — это растворы сильных электролитов (щелочей, солей, кислот — NaOH, K2S04, HN03, НС1О4).
Раньше существовали две точки зрения на природу растворения и растворов: физическая и химическая. Согласно первой растворы рассматривали как механические смеси, согласно второй — как нестойкие химические соединения частиц растворенного вещества с водой или другим растворителем. Последняя теория была высказана в 1887 г. Д. И. Менделеевым, который посвятил исследованию растворов более 40 лет. Современная химия рассматривает растворение как физико-химический процесс, а растворы как физико-химические системы.
Более точное определение раствора таково:
Раствор — гомогенная (однородная) система, состоящая из частиц растворенного вещества, растворителя и продуктов их взаимодействия.
Поведение и свойства растворов электролитов, как вы хорошо знаете, объясняет другая важнейшая теория химии — теория электролитической диссоциации, разработанная С. Аррениусом, развитая и дополненная учениками Д. И. Менделеева, и в первую очередь И. А. Каблуковым.
Вопросы для закрепления:
1. Что такое дисперсные системы?
2. При повреждении кожи (ранке) наблюдается свертывание крови — коагуляция золя. В чем сущность этого процесса? Почему это явление выполняет защитную функцию для организма? Как называют болезнь, при которой свертывание крови затруднено или не наблюдается?
3. Расскажите о значении различных дисперсных систем в быту.
4. Проследите эволюцию коллоидных систем в процессе развития жизни на Земле.
Комплексные соли
I. Это сложные вещества, в состав которых входят комплексный катион и анион, либо катион и комплексный анион.
Например,
Na2[Zn(OH)4] →2Na+ + [Zn(OH)4]2-
[Zn(OH)4]2- - комплексный анион
[Ag(NH3)2]Cl → [Ag(NH3)2]+ + Cl-
[Ag(NH3)2]+ - комплексный катион
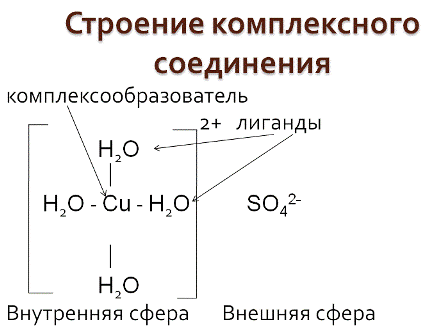
1) Ионы противоположного знака, связанные с комплексным ионом, образуют внешнюю сферу.
2) Комплексный ион состоит из комплексообразователя и лигандов и образует внутреннюю сферу (внутреннюю сферу заключают в квадратные скобки).
· комплексообразователь – это d-элемент, имеющий на внешнем уровне достаточное количество свободных орбиталей (Cu+2, Ag+, Pt+4, Fe+2, Fe+3, Co+2, Co+3, Co+2)
· лиганды– это ионы и молекулы, имеющие свободные электронные пары (OH-, CN-, Cl-, NH3, H2O)
· координационное число - это число лигандов в комплексном ионе

II. Виды комплексов
— Катионные
[Co(NH3)6]3+
— Анионные
[CoF6]3-
— нейтральные
[Al (H2O)3(OH)3]
Соединения с комплексными анионами:
K2[PtCl4] - тетрахлороплатинат (II) калия
Na2[Zn(OH)4] - тетрагидроксоцинкат натрия
Na[Cr(H2O)2F4] - тетрафтородиаквахромат (III) натрия
Соединения с комплексными катионами:
[Ag(NH3)2]Cl – хлорид диамминсеребра
[Al(H2O)5OH]SO4 – сульфат гидроксопентаакваалюминия
[Pt(H2O)(NH3)2OH] NO3 – нитрат гидроксодиамминакваплатины (II)
Соединения без внешней сферы
[Al (H2O)3(OH)3] - тригидроксотриакваалюминий
[Pt(NH3)2Cl2] – дихлородиамминплатина (II)
[Co(NH3)3Cl3] – трихлоротриамминкобальт (III)
III. Номенклатура
· в названиях комплексных ионов сначала указываются лиганды;
· название комплексного иона завершается названием металла с указанием его степени окисления (римским цифрами в скобках);
· в названиях комплексных катионов используются русские названия металлов;
· в названиях комплексных анионов используются латинские названия металлов: Al –алюминат, Cr – хромат, Fe – феррат;
· названия лигандов:
| Лиганд | Название |
| NH3 | аммин |
| H2O | аква |
| CO | карбонил |
| F- | фторо |
| Cl- | хлоро |
| CN- | циано |
| OH- | гидроксо |
| CNS- | тиоцианато |
| NO3- | нитрато |
| NO2- | нитро |
· Умножающие приставки:
2 - ди
3 – три
4 – тетра
5 – пента
6 – гекса
IV. Примеры
K4[Fe(CN)6] – гексацианоферрат (II) калия (жёлтая кровяная соль)
K3[Fe(CN)6] – гексацианоферрат (III) калия (красная кровяная соль)
Na2[Zn(OH)4] – тетрагидроксоцинкат (II) натрия
[Ag(NH3)2]Cl – хлорид диамминсеребра (I)
[Cu(NH3)4]SO4 – сульфат тетраамминмеди (II)
[Cu(H2O)4]SO4 ∙ H2O – сульфат тетрааквамеди (II) (медный купорос)
|
из
5.00
|
Обсуждение в статье: Соединения без внешней сферы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

