 |
Главная |
Механизмы образования ДЭС
|
из
5.00
|
 | |||
 |
| Принцип методов электрофоретического разделения заключается в способности молекул пептидов и аминокислот, находясь в заряженной форме в виде катионов или анионов, двигаться в электрическом поле с определённой скоростью. Впервые метод электрофореза был разработанный Тизелиусом с использованием бумаги в качестве носителя и специальных оптических приборов, регистрирующих смещение границы раствора белка и растворителя по показателю преломления (фронтальный электрофорез). | 
|
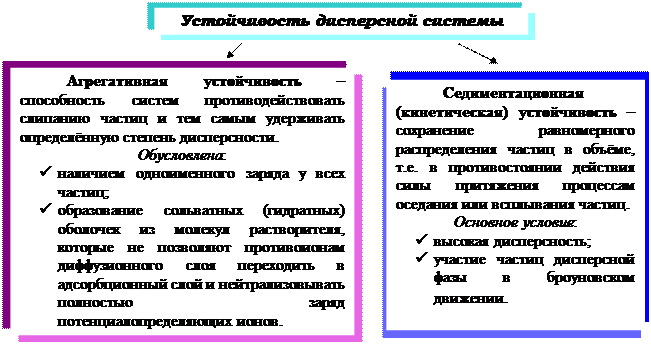
Устойчивость дисперсной системы – это способность её в течение определённого времени сохранять неизменными состав и основные свойства (дисперсность, концентрацию, распределение частиц дисперсной фазы в определённом объеме дисперсионной среды и характер взаимодействия между частицами).
Если Fпритяжения > Fотталкивания ‑ преобладают силы притяжения – происходит коагуляция коллоидного раствора;
Если Fпритяжения < Fотталкивания – преобладают силы отталкивания ‑ система становится более устойчивой.
 |
Коагуляция ‑ процесс слипания частиц дисперсной фазы при утрате системой агрегативной устойчивости.
Коагуляцию вызывают (уменьшение сил отталкивания и увеличение сил притяжения между коллоидными частицами):
· действием температуры (нагревание и замораживание);
· интенсивным перемешиванием, центрифугированием;
· добавлением электролитов (уменьшают толщину двойного электрического слоя и величину ζ-потенциала).
Этапы коагуляции:
Ä Приближение частиц дисперсной фазы, взаимная фиксация их. Образование агрегатов из нескольких частиц, разделённых прослойками дисперсионной среды.
Ä Разрушение прослоек среды и непосредственный контакт частиц. Образование агрегатов прочной структуры из твердых частиц – осадок.
Коагуляция золей электролитами подчиняется правилам:
1.Все электролиты при увеличении их концентрации в золе до определённого значения вызывают коагуляцию. Коагуляция происходит при определённом количестве добавленного электролита.
Порог коагуляции (ПК) – минимальная молярная концентрация вещества эквивалента электролита (моль/л или ммоль/л), что вызывает за определённый промежуток времени коагуляцию коллоидного раствора.
Величина, обратная порогу коагуляции, называется коагулирующей способностью (КС).
КС = 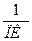 ;
;
Коагулирующая способность иона-коагулятора показывает объём коагулированного золя 1 молем (ммолем) иона-коагулятора.
2.Коагулирующее действие проявляет не вся молекула электролита, а лишь тот ион, который имеет заряд, противоположный заряду гранулы (ион-коагулятор). Правило значности (правило Гарди).
3.Коагулирующее действие иона-коагулятора тем больше, чем выше его валентность. Правило валентности (правило Шульца).
4.В ряду неорганических ионов с одинаковым зарядом их коагулирующая активность возрастает с уменьшением радиуса гидратированного (сольватного) иона.
Li+ < Na+ < K+ < Rb+ < Cs+; Cl- < Br- < I- < CNS-.
5.В гомологических рядах электролитов с органическими ионами коагулирующая способность равномерно возрастает с увеличением –СН2-групп. При увеличении концентрации электролита в растворе уменьшается электрокинетический потенциал коллоидных частиц, и коагуляция наступает при его определённом значении – критическом потенциале. Для большинства систем критический потенциал равен 0,03В.

Начавшуюся коагуляцию остановить невозможно, но можно коллоидную систему заранее защитить, добавив в неё защитное вещество (растворы желатины, танина и других высокомолекулярных соединений). Их защитное действие выражается в повышении порога коагуляции. Оно связано с адсорбцией их молекул на поверхности коллоидных частиц. Образующийся на поверхности коллоидных частиц защитный слой препятствует их слипанию.
Количественно способность ВМС защищать золи от коагуляции определяют защитным числом (равно числу миллиграммов сухого ВМС, защищающего 10 мл золя от коагуляции при добавлении к нему 1мл 10%-го раствора NaCl).
При добавлении к золю золота небольшого количества желатина, гидрозоль золота стаёт более устойчивым. При добавлении к нему электролитов в количествах, значительно превышающих порог коагуляции, а также при длительном его стоянии, этот золь практически не изменяется. Явление – коллоидная защита.
Роль коллоидной защиты:
· Белки крови защищают капли жира, холестерина и другие гидрофобные вещества от коагуляции. При некоторых заболеваниях содержание защитных белков в крови уменьшается, что приводит к отложению холестерина на стенках сосудов, образование камней в почках и печени.
· Способность крови удерживать в связанном состоянии большое количество газов (СО2 и О2) обусловлена защитным действием белков (белки обволакивают микропузырьки этих газов и мешают слиянию).
 |
|
из
5.00
|
Обсуждение в статье: Механизмы образования ДЭС |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

