 |
Главная |
Реакции восстановления
|
из
5.00
|
v Реакции каталитического гидрирования. Это общий метод превращения двойной углерод-углеродной связи в одинарную С–С-связь. Поскольку реакция обычно протекает количественно, и объем израсходованного водорода можно измерить, гидрирование часто используют в аналитических целях.
В процессе гидрирования алкенов происходит разрыв π-связи (DН ~260 кДж/моль) и связи Н–Н (DН ~435 кДж/моль), а также образование двух связей С–H (DН ~ -410 кДж/моль на каждую связь), в результате реакции выделяется энергия (DН ~ -125 кДж/моль).


Ø Теплота гидрирования – количество тепла, выделяющееся при гидрировании 1 моль ненасыщенного соединения.
Гидрирование – реакция экзотермическая, однако, в отсутствии катализатора она протекает с незначительной скоростью даже при повышенной температуре. Алкены устойчивы к действию водорода в момент выделения. Для того чтобы проходило гидрирование, необходима очень большая энергия активации. Катализатор ее понижает настолько, что реакция может протекать при комнатной температуре. Он, конечно, не влияет на суммарное изменение энергии всей реакции, а просто понижает энергетический барьер между исходными и конечными веществами.
Правда, одновременно с ускорением реакции гидрирования в равной мере ускоряется и обратная реакция дегидрирования, т.е. катализатор способствует более быстрому установлению равновесия. Поэтому в реакциях как гидрирования, так и дегидрирования применяют одни и те же катализаторы, а, используя различные условия реакции, изменяющие условия сорбции и десорбции исходных или конечных продуктов реакции, ее удается направить в нужную сторону.
Катализатор, понижая энергию активации, направляет реакцию по другому механизму. Предполагают, что на поверхности катализатора происходит не только разрушение π-связи алкена, но и активация молекулы водорода.
Гидрирование алкенов можно проводить как гетерогенный или гомогенный каталитический процесс.
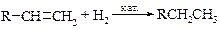
§ В качестве гетерогенных катализаторов гидрирования при комнатной температуре используют мелкодисперсную платину, катализаторы Адамса[9] – оксиды платины и палладия, которые при взаимодействии с водородом образуют насыщенные водородом платиновую чернь или палладий, а при температурах 150-300 ºС – никель Ренея. Свежеприготовленные катализаторы для придания им структурной устойчивости наносят на носители, такие как активированный уголь, кизельгур, оксид алюминия.
Выдающийся вклад в изучение гидрирования органических соединений в присутствии металлов внес П. Сабатье. Схематически этот процесс можно представить таким образом:
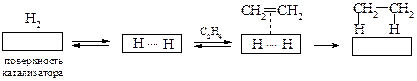
В этом случае на поверхности катализатора может происходить синхронное цис-присоединение водорода. Например, гидрирование (Z)-2,3-диметилбутендиовой (2,3-диметилмалеиновой) кислоты над палладием приводит исключительно к (2R,3S)-2,3-диметилянтарной кислоте в виде мезо-формы.
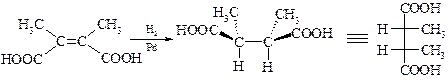
Поскольку для гидрирования необходима адсорбция молекул олефина на катализаторе по двойной связи, алкены гидрируются тем легче, чем меньше заместителей у двойной связи (правило Лебедева).
§ Теплоты гидрирования часто дают ценную информацию об относительной неустойчивости ненасыщенных соединений, например, цис-бутен-2 имеет теплоту гидрирования 120,1 кДж/моль, а его транс-изомер – 115,9 кДж/моль. Это означает, что запас потенциальной энергии в последнем изомере на 4,2 кДж/моль меньше. Другими словами, транс-изомер устойчивее цис-изомера, т.к. два объемных заместителя в этой молекуле расположены по разные стороны двойной связи. Поэтому как пространственные препятствия, так и ван-дер-ваальсовые силы отталкивания между соседними заместителями у транс-алкенов меньше.

Для циклоалкенов с малыми и обычными циклами (С3-С7) реализуется только цис-конфигурация. Только начиная с циклооктена возможно существование стабильных соединений с транс-конфигурацией двойной связи. Для циклооктена транс-изомер на 38 кДж/моль менее устойчив по сравнению со своим цис-изомером.

цис- и транс-циклооктены
По степени замещения при двойной связи и, соответственно, устойчивости и трудности гидрирования алкены образуют следующий ряд:
CH2=CH2 < RCH=CH2 < RCH=CHR < R2C=CH2 < R2C=CHR < R2C=CR2 .
Эта закономерность подтверждается данными соответствующих теплот гидрирования (см. Таблицу 8.2).
Таблица 8.2
|
из
5.00
|
Обсуждение в статье: Реакции восстановления |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

