 |
Главная |
Требования к осаждаемой форме:
|
из
5.00
|
1) Малая растворимость осаждаемой формы соединения, содержащего определенное вещество и как более низкое содержание в ней определяющего вещества.

осаждаемая форма весовая форма

Требование к осаждению – малая растворимость.
Произведение растворимости 
К ним относятся: AgCl, BaSO4, Fe(OH)3, Sb2S3
2) Структура осадка должна отвечать условиям фильтрования и позволять отмывку осадков с достаточной скоростью.
Мелкокристаллические осадки, могут пройти через поры фильтра. Наиболее удобны крупнокристаллические осадки, т.к. они не забивают поры фильтра, имеют слабо развитую поверхность, мало адсорбируют посторонние ионы и легко отмываются от них. Фильтруются через фильтр средней плотности, маркируемый Белой лентой. Аморфные осадки, например, многие гидроксиды имеют сильно развитую поверхность, адсорбируют посторонние вещества из раствора и трудно от них отмываются. Фильтрование таких осадков проводят через неплотный фильтр, маркируемый Красной лентой. Самые мелкокристаллические осадки (например, BaSO4), фильтруются через фильтр с Синей лентой.
Окклюзия – внедрение посторонних ионов в структуру кристаллической решетки.
BaSO4
| ° | xBa 2+ | ° | x |
| x | ° | K+ | ° |
K+ - 1, 37 A
Na+ - 0, 95 A
Ba+2 -1,35 A
3) Важно, чтобы осаждаемая форма легко переходила в весовую.
Осаждаемая и весовая формы должны быть химически инертными, чтобы не приводить к количественным ошибкам.
Пример:
1) 

2) 

CaO - высокореакционное вещество, это означает, что оно может «захватить» пары воды или углекислый газ
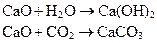
 белая лента
белая лента
красная лента фильтры
синяя лента
Требования к весовой форме:
1) Точное соответствие ее состава химической формуле. Если такого соответствия нет, вычисление результатов невозможно.
2) Химическая устойчивость весовой формы.
3) Содержание определяемого в весовой форме должно быть как можно меньшим, тогда погрешности определения меньше скажутся на окончательном результате анализа.
Искомое процентное содержание ( Р ) рассчитывают по формуле:
 ,
,
где b – количество весовой формы
a – навеска исследуемого вещества
F – фактор пересчета
Фактор пересчета показывает, скольким граммам определяемого элемента соответствует 1 г весовой формы.
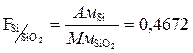
Из двух возможных гравиметрических методов определения элемента при прочих равных условиях будет более точным тот, для которого фактор пересчета будет меньше.
 ;
; 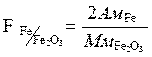 ;
; 
Анализ может быть:
а) частным – определяется один или несколько веществ, а другие не интересуют

б) полным – на содержание всех входящих составных частей (Σ = 100%).
Полный анализ проводится для того, чтобы узнать все составные части данного вещества.
Цемент – CaO, MgO, Fe2O3, Al2O3, SiO2, CaSO4, SO3.
FeCl3 + NH4OH → Fe2(OH)3.
Тема 3. Титриметрический анализ [4] стр. 199-205
Титрование – процесс определения содержания вещества по количеству израсходованного стандартного реагента. При титровании расходуется количество реагента, эквивалентное количеству титруемого вещества, в соответствии со стехиометрией реакции между ними при условии, что эта реакция практически необратима. Конечную точку титрования фиксируют по изменению окраски титруемого раствора или индикатора, который добавляют в ходе реакции, или устанавливают по излому или скачку на кривой титрования. По типу реакции, используемой при титровании, различают: кислотно-основное, окислительно-восстановительное, осадительное и комплексонометрическое титрование; по способу индикации конечной точки титрования – визуальное, потенциометрическое, фотометрическое, кондуктометрическое, амперометрическое титрование. Титрование проводят двумя способами: пипетирования и отдельных навесок.
Стандартный раствор (титрант) – раствор с точно известной концентрацией.
Исходное вещество – химическое соединение, используемое для приготовления раствора с точно известной концентрацией (первичный стандарт), удовлетворяющее ряду требований: 1) вещество должно быть химически чистым; 2) состав вещества должен точно соответствовать формуле; 3) вещество должно быть устойчивым при хранении; 4) должно иметь, возможно, большую молярную массу эквивалента. Лишь немногие вещества удовлетворяют этим требованиям.
Первичный стандарт – раствор, концентрация которого точно известна, приготовленный из исходного вещества. Первичные стандарты используют как для обычных титриметрических определений, так и для установления точной концентрации растворов вторичных стандартов.
Фиксанал – запаянная ампула, в которой находится определенное количество соответствующего вещества. Фиксаналы используют для приготовления растворов первичных стандартов.
Вторичные стандарты – растворы, приготовленные с примерно известной концентрацией, а затем их точную концентрацию устанавливают(стандартизируют) по раствору первичного стандарта.
Титр (Т) стандартного (рабочего) раствора – масса вещества (в граммах), содержащаяся в одном миллилитре данного раствора, г/мл.
Титр по определяемому веществу ( ТА/В) – масса определяемого вещества (А), с которой реагирует один миллилитр данного раствора (В).
Эквивалент – реальная или условная частица вещества, которая в кислотно-основной реакции эквивалентна одному иону водорода или (в окислительно-восстановительной реакции) одному электрону.
Фактор эквивалентности [fэквив.(А)] – число, обозначающее, какая доля реальной частицы вещества А эквивалентна одному иону водорода или одному электрону.
Молярная концентрация эквивалента [С(А)⋅f ] – масса моля эквивалента, численно равная произведению фактора эквивалентности на молярную массу вещества.
Правило эквивалентов – вещества реагируют в объемах, обратно пропорциональных молярным концентрациям их эквивалентов: C1 ⋅ V1 = C2 ⋅V2.
Прямое титрование – определяемое вещество в процессе титрования непосредственно реагирует с раствором титранта: А + В → продукты реакции, где А – раствор определяемого вещества; В – раствор титранта.
Обратное титрование – к раствору определяемого вещества добавляют точно известное количество другого вещества в избытке (титрант 1); не вступившее в реакцию количество титранта 1 оттитровывают титрантом 2:
А + В1 → продукты реакции + остаток В1,
В1 + В2 → продукты реакции.
Титрование заместителя (косвенное титрование) – к раствору определяемого вещества добавляют вспомогательный раствор реагента (заведомо в избытке, для смещения равновесия реакции вправо). Продукт реакции (заместитель), количество эквивалентов которого в точности равно количеству эквивалентов определяемого вещества, оттитровывают раствором титранта:
А + Д → продукты реакции + С,
С + В → продукты реакции,
где Д – раствор вспомогательного реагента; С – заместитель; В – раствор титранта.
Точка эквивалентности (т. эк.) – момент, когда определяемое вещество полностью прореагировало с раствором титранта. Т. эк. – понятие теоретическое.
Точка конца титрования (т. к. т.) – момент изменения физического свойства (изменение окраски) титруемого раствора, связанный с эквивалентностью.
Чаще всего это изменение фиксируется индикаторным или инструментальным способом. Следовательно, т. к. т. – понятие практическое. Разность объемов титранта в т. эк. и т. к. т. мала, но она существует из-за неадекватности изменения физического свойства и нашей способности наблюдать его. V (т. эк.) ≠ V(т. к. т.). Этим обусловливается наличие индикаторной ошибки титрования.
 Индикаторы – химические вещества, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации того или иного компонента в растворе. Существуют кислотно-основные, окислительно-восстановительные, адсорбционные и комплексонометрические (металл индикаторы) индикаторы.
Индикаторы – химические вещества, изменяющие окраску, люминесценцию или образующие осадок при изменении концентрации того или иного компонента в растворе. Существуют кислотно-основные, окислительно-восстановительные, адсорбционные и комплексонометрические (металл индикаторы) индикаторы.

Рисунок 1. Пипетки Рисунок 2. Бюретки
Титриметрический анализ – метод определения количества вещества путем точного измерения объема растворов веществ, вступающих между собой в реакцию.
Титр– количество г. вещества содержащегося в 1 мл. раствора или эквивалентное определяемому веществу. Например, если титр H2SO4 равен 0,0049 г/мл, это значит, что каждый мл раствора содержит 0,0049 г. серной кислоты.
Раствор, титр которого известен, называется титрованным.
Титрование– процесс добавления к исследуемому раствору или его аликвотной части эквивалентного количества титрованного раствора. При этом используются стандартные растворы – фиксаналы – растворы с точной концентрацией вещества (Na2CO3, HCl).
Реакция титрования должна отвечать следующим требованиям:
1) высокая скорость реакции;
2) реакция должна протекать до конца;
3) реакция должна быть высоко стехиометричной;
4) иметь удобный метод фиксирования конца реакции.
HCl + NaOH → NaCl + H2O
Главная задача титриметрического анализа – не только использовать раствор точно известной концентрации (фиксанал), но и правильно определить точку эквивалентности.
Способы фиксации точки эквивалентности:
I. По собственной окраске ионов определяемого элемента, например марганца в виде аниона MnO4-
|
из
5.00
|
Обсуждение в статье: Требования к осаждаемой форме: |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

