 |
Главная |
Форма отчета к практической работе № 1
|
из
5.00
|
Практическая работа № 1
Тема: Приготовление раствора заданной концентрации.
Цель работы: Отработать навыки решения расчетных задач.
Теоретическая часть
Правило смешения или «конверт Пирсона».
При решении задач на растворы с разными концентрациями чаще всего применяют диагональную схему правила смешении. При расчетах записывают одну над другой массовые доли растворенного вещества в исходных растворах, справа между ними – его массовую долю в растворе, который нужно приготовить, и вычитают по диагонали из большего меньшее значение. Разности их вычитаний показывают массовые доли для первого и второго растворов, необходимые для приготовления нужного раствора.

ЗАДАЧА 1
Определите концентрацию раствора, полученного при слиянии 150 г 30%-го и 250 г 10%-го растворов какой-либо соли.
Дано:
m1 = 150 г,
m2 = 250 г,
W1 = 30%,
W2 = 10%.
Найти: W3.
Решение:
1-й способ (метод пропорций).
Общая масса раствора:
m3 = m1 + m2 = 150 + 250 = 400 г.
Массу вещества в первом растворе находим методом пропорций, исходя из определения: процентная концентрация раствора показывает, сколько граммов растворенного вещества находится в 100 г раствора:
100 г 30%-го р-ра – 30 г в-ва,
150 г 30%-го р-ра – х г в-ва,
х = 150•30/100 = 45 г.
Для второго раствора составляем аналогичную пропорцию:
100 г 10%-го р-ра – 10 г в-ва,
250 г 10%-го р-ра – y г в-ва,
y = 250•10/100 = 25 г.
Следовательно, 400 г нового раствора содержит 45 + 25 = 70 г растворенного вещества.
Теперь можно определить концентрацию нового раствора:
400 г р-ра – 70 г в-ва,
100 г р-ра – z г в-ва,
z = 100•70/400 = 17,5 г, или 17,5%.
2-й способ (алгебраический).
m1•W1 + m2•W2 = W3(m1 + m2). Отсюда
W3 = (m1•W1 + m2•W2)/(m1 + m2). В результате находим:
W3 = (150•30 + 250•10)/(150 + 250) = 17,5%.
3-й способ (правило креста).

(W3 – 10)/(30 – W3) = 150/250. Тогда
(30 – W3)•150 = (W3 – 10)•250,
4500 – 150W3 = 250W3 – 2500,
4500 – 2500 = 250W3 – 150W3,
7000 = 400W3
3 = 7000/400 = 17,5%.
Ответ. При слиянии взятых растворов получится новый раствор с концентрацией W3 = 17,5%.
ЗАДАЧА 2
Определите, сколько нужно взять 10%-го раствора соли и 30%-го раствора этой же соли для приготовления 500 г 20%-го раствора.
Дано:
W1 = 10%,
W2 = 30%,
W3 = 20%,
m3 = 500 г.
Найти: m1, m2.
Решение
Используем правило креста.

Для приготовления 500 г 20%-го раствора соли нужно взять по 10 частей растворов исходных концентраций.
Проверим правильность нашего решения, учитывая, что 1 часть равна 500/(10 + 10) = 25 250 г 10%-го р-ра – х г соли,
100 г 10%-го р-ра – 10 г соли,
х = 250•10/100 = 25 г.
250 г 30%-го р-ра – y г соли,
100 г 30%-го р-ра – 30 г соли,
y = 250•30/100 = 75 г.
m(р-ра) = 250 + 250 = 500 г.
m(соли) = 25 + 75 = 100 г. Отсюда находим W3:
500 г р-ра – 100 г соли,
100 г р-ра –W3 г соли,
W3 = 100•100/500 = 20 г, или 20%.
Ответ. Для приготовления 500 г 20%-го раствора нужно взять исходные растворы по 250 г (m1 = 250 г, m2 = 250 г).
ЗАДАЧА 3
Определите массу раствора Nа2СО3 10%-й концентрации и массу сухого кристаллогидрата Na2CO3•10H2O, которые нужно взять для приготовления 540 г раствора 15%-й концентрации.
Дано:
W1 = 10%,
W3 = 15%,
m3 = 540 г.
Найти: m1, m2.
Решение
1-й способ (через систему уравнений с двумя неизвестными).
Определяем массу соли Na2CO3 в 540 г 15%-го раствора:
100 г 15%-го р-ра – 15 г соли,
540 г 15%-го р-ра – z г соли,
z = 540•15/100 = 81 г.
Cоставляем систему уравнений:
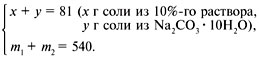
Находим молярную массу:

Избавляемся от лишних неизвестных: m2 = 286y/106;
100 г 10%-го р-ра – 10 г соли,
m1 г 10%-го р-ра – х г соли,
m1 = 100х/10 = 10х.
Подставляем m2 и m1 в систему уравнений:

С учетом того, что х = 81 – y, избавляемся от второго неизвестного:
10(81 – y) + 286y/106 = 540. Отсюда
y = 270/7,3 = 37 г.
Тогда m2 = 286y/106 = 2,7•37 100 г – это масса необходимого количества кристаллогидрата Na2СО3•10H2O.
Далее находим: х = 81 – y = 81 – 37 = 44 г – это масса соли из 10%-го раствора.
Находим массу 10%-го раствора:
100 г 10%-го р-ра – 10 г соли,
m1 г 10%-го р-ра – 44 г соли,
m1 = 100•44/10 = 440 г.
2-й способ (правило креста).
Допустим, что Na2СО3•10H2O – это «сухой раствор» (ведь он же содержит воду). Тогда найдем его «концентрацию»:

286 г – 106 г соли,
100 г – х г соли,
х = 100•106/286 = 37 г, или 37%.
Применяем правило креста.

Находим массу одной части и массы веществ: 540/27 = 20 г,
m1 = 20•22 = 440 г, m2 = 20•5 = 100 г.
Ответ. Для приготовления 540 г раствора Na2CO3 15%-й концентрации необходимо взять 440 г 10%-го раствора и 100 г кристаллогидрата.
Упражнения
1.Сколько миллилитров воды надо прилить к 80 г 5 %-ного раствора соли, чтобы получить 2 %-ный раствор?
2.Сколько грамм соли надо добавить к 150 г 0,5 %-ного раствора этой соли, чтобы получить 6 %-ный раствор?
3.Сколько миллилитров воды надо прилить к 200 г 6 %-ного раствора сахара, чтобы получить 1,5 %-ный раствор сахара?
4.Сколько воды надо прилить к 80 г 10 %-ного раствора гидроксида натрия, чтобы получить 3 %-ный раствор?
5.Сколько грамм сахара надо добавить к 300 г 2 %-ного раствора, чтобы получить 5 %-ный раствор?
6.Сколько миллилитров воды надо добавить к 70 г 20 %-ного раствора серной кислоты, чтобы получить 3 %-ный раствор?
7.Сколько воды нужно добавить к 250 г раствора соли для понижения его концентрации с 45% до 10%?
8.Сколько сухой соли нужно добавить к 250 г раствора 10%-й концентрации для ее увеличения до 45%?
Форма отчета к практической работе № 1
1.Номер практической работы
2.Наименование практической работы
3.Цель
4.Решение задач
5.Список использованных источников
|
из
5.00
|
Обсуждение в статье: Форма отчета к практической работе № 1 |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

