 |
Главная |
Твердые тела (структура и свойства)
|
из
5.00
|
В твердых телах атомы располагаются в относительном порядке (каждый относительно остальных), что обеспечивается наличием постоянных связей между ними. Квантовомеханическое уравнение Шредингера, описывающее характер движения электронов в атоме, дает возможность объяснить и природу связей, возникающих между атомами при образовании кристаллической структуры твердых тел. При достаточном сближении атомов (молекул) между ними возникает взаимодействие, приводящее к появлению сил притяжения и отталкивания.
Наиболее общим видом связи, возникающим между любыми атомами и молекулами, являются силы Ван-дер-Ваальса. Впервые эти силы были введены для объяснения отступления реальных газов от уравнения состояния идеальных газов. Отсюда происходит и их название. В уравнении Ван-дер-Ваальса
 (1)
(1)
эти силы определяют поправку (a/V 2). Поправка b учитывает действие сил отталкивания.
Замечательным свойством сил Ван-дер-Ваальса является то, что они возникают между электрически нейтральными системами и системами, не обладающими электрическим моментом. При взаимодействии инертных газов они являются единственными силами, делающими возможным существование жидкого и твердого состояния этих веществ.
Атомы, стоящие в периодической системе Менделеева рядом с инертными газами, обладают склонностью принимать их конфигурацию путем отдачи или принятия электронов. У атомов щелочных металлов, стоящих непосредственно за инертными газами, валентный электрон движется вне заполненного слоя и связан с ядром слабо. У галоидов, стоящих непосредственно перед инертными газами, недостает одного электрона для заполнения устойчивого слоя благородного газа. Поэтому они обладают высоким сродством к дополнительному электрону.
Связь между такого рода атомами, т. е. между типичными металлами и галоидами осуществляется следующим образом. Вначале происходит ионизация обоих атомов: электрон от атома металла переходит к атому галоида. При этом атом металла превращается в положительно заряженный ион, атом галоида - в отрицательно заряженный ион. Эти ионы взаимодействуют между собою по закону Кулона, как два разноименных заряда. Такая связь получила название ионной или полярной.
Наличием двух типов связей (полярной и Ван-дер-Ваальсовой связи) невозможно объяснить существование большого твердых тел. В частности, однородные атомы не могут образовать, очевидно, противоположно заряженных ионов путем перераспределения валентных электронов, как это имеет место при взаимодействии металлов с галоидами. В действительности для твердых тел, состоящих из одинаковых атомов, реализуется ковалентный тип связей. Такой тип связей называют также гомеополярной и обменной.
Ковалентная связь возникает при сближении атомов одной и той же природы (например атома А и атома В). Рассмотрим у каждого из этих атомов два валентных электрона (1 и 2). Ядра этих атомов обозначим как а и b. Вследствие того что плотность электронного облака, описывающего состояние электрона в атоме, очень быстро падает с расстоянием, обнаружить электрон 1 у ядра b,а электрон 2у ядра а весьма маловероятно. Расчет показывает, что при r = 50 А каждый из электронов может побывать у «чужого» ядра один раз в среднем за 1012 лет. Поэтому атомы А и В можно рассматривать как изолированные и энергию системы, состоящей из таких атомов, следует принимать равной 2Е0,где Е0- энергия изолированного атома в нормальном состоянии.
По мере сближения атомов вероятность перехода электронов к «чужим» ядрам увеличивается. При некотором достаточно малом расстоянии между ядрами атомов наступает заметное перекрытие электронных облаков этих атомов, а частота перехода увеличивается уже примерно до 1014 сек-1. При дальнейшем сближении степень перекрытия облаков растет и частота обмена электронов местами увеличивается настолько, что теряет смысл говорить о принадлежности электрона 1 к атому А, а электрона 2к атому В. Это соответствует возникновению нового состояния, не свойственного системе, состоящей из двух изолированных атомов, и замечательного тем, что электроны в этом состоянии принадлежат одновременно обоим ядрам, или, как говорят, обобществлены.
Существует еще один вид связей между одинаковыми атомами – металлическая связь. Такая связь характерна для металлов: в узлах решетки металлов находятся положительно заряженные ионы, химическая связь между которыми осуществляется с помощью свободных электронов, образующих электронный газ. Металлическая связь возникает в том случае, когда невелико число валентных электронов, а при этом они слабее связаны с ядрами. При образовании металлов электронные оболочки валентных электронов перекрываются, поэтому валентные электроны получают возможность переходить от одного атома к другому и свободно перемещаться по всему кристаллу. Свободные электроны связывают положительные ионы в прочную структуру. Металлическая связь более гибка и пластична, чем ионная. В металлах происходит обобществление электронов; эти электроны все время находятся между атомами. В случае металлической связи в обобществлении валентных электронов участвуют все атомы кристалла и обобществленные электроны не локализуются уже у своих атомов, а свободно перемещаются внутри всей решетки.
Следует отметить, что наиболее универсальной связью является связь Ван-дер-Ваальса. Она возникает во всех без исключения случаях. Вместе с этим это – наиболее слабая связь с энергией, не превышающей единиц 8×103 дж/моль.В чистом виде она проявляется при взаимодействии нейтральных атомов и молекул, имеющих заполненные внутренние электронные оболочки. В частности, силы Ван-дер-Ваальса обусловливают существование жидкого и твердого состояний инертных газов, водорода, кислорода, азота и многих органических и неорганических соединений, обеспечивают связь в обширной группе валентно-молекулярных кристаллов; это будет более подробно изложено далее. Вследствие того, что энергия Ван-дер-Ваальсовой связи низка, все структуры, обусловленные этой связью, малоустойчивы, легко летучи и имеют низкие точки плавления.
Ионная связь является типичной химической связью, широко распространенной среди неорганических соединений. К ним относятся соединения металлов с галоидами, окислы металлов, сульфиды и многие другие полярные соединения. Ионная связь присуща также многим интерметаллическим соединениям (карбиды, селениды, нитриды и др.). Энергия ионной связи значительно выше энергии Ван-дер-Ваальса: она колеблется примерно от 6,7×105 дж/моль (для КСl) до 1,5-107 дж/моль(для окисей алюминия и хрома). Поэтому твердые тела с ионной связью имеют высокие теплоты сублимации и высокие точки плавления.
Ковалентная связь имеет исключительно широкое распространение в органических соединениях, но встречается также в неорганических соединениях, в некоторых металлах и во многих интерметаллических соединениях. Эта связь обусловливает образование валентных кристаллов типа алмаза, германия и т. п.. Энергия валентной связи высока: одинарная связь «углерод - углерод» (С - С) в органических соединениях обладает энергией порядка 3-105 дж/моль.Такую же величину имеет эта связь и в решетке алмаза, о чем свидетельствуют высокая температура плавления и большая теплота сублимации.
Наконец, металлическая связь, возникающая в результате обобществления валентных электронов, характерна для типичных металлов и многих интер металлических соединений. Энергия этой связи по порядку величины сравнима с энергией валентной связи.
Следует подчеркнуть, что в реальных твердых телах каждая из рассмотренных связей в чистом виде почти никогда не встречается. Практически всегда имеет место наложение двух и более типов связей. Одна из них имеет, как правило, превалирующее значение, определяя структуру и свойства тела.
Для описания правильной внутренней структуры твердых тел пользуются понятием пространственной или кристаллической решетки. 

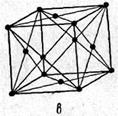 Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются частицы, образующие твердое тело. Пример такой решетки приведен на рис. 1.2. Жирными линиями выделен наименьший параллелепипед, последовательным перемещением которого вдоль трех своих осей может быть построен весь кристалл. Этот параллелепипед называется элементарной или основной ячейкой решётки.Для однозначной ее характеристики необходимо задать 6 величин: три ребра (а, b, с)и три угла между осями (a, b, g). Эти величины называются параметрами решетки. Простейшим типом решеток являются кубические, у которых а = b = с и a, b, g = 90°. В ряде случаев, для более ясного изображения симметрии решеток, элементарные ячейки строятся таким образом, что они содержат частицы не только в своих вершинах, но и в других точках. Так, объемно-центрированные решетки содержат дополнительную частицу в точке пересечения пространственных диагоналей (рис. 1.3, б),гранецентрированные решетки содержат дополнительные частицы в точках пересечения диагоналей граней (рис. 1.3, в) и т. д.
Кристаллическая решетка представляет собой пространственную сетку, в узлах которой располагаются частицы, образующие твердое тело. Пример такой решетки приведен на рис. 1.2. Жирными линиями выделен наименьший параллелепипед, последовательным перемещением которого вдоль трех своих осей может быть построен весь кристалл. Этот параллелепипед называется элементарной или основной ячейкой решётки.Для однозначной ее характеристики необходимо задать 6 величин: три ребра (а, b, с)и три угла между осями (a, b, g). Эти величины называются параметрами решетки. Простейшим типом решеток являются кубические, у которых а = b = с и a, b, g = 90°. В ряде случаев, для более ясного изображения симметрии решеток, элементарные ячейки строятся таким образом, что они содержат частицы не только в своих вершинах, но и в других точках. Так, объемно-центрированные решетки содержат дополнительную частицу в точке пересечения пространственных диагоналей (рис. 1.3, б),гранецентрированные решетки содержат дополнительные частицы в точках пересечения диагоналей граней (рис. 1.3, в) и т. д.
 | |||
 |
Таким образом, частицы твердого тела расположены в решетке правильными рядами (рис. 1.4). Как следствие, в зависимости от типа кристаллической решетки свойства твердого тела будут зависеть от направления воздействия на это твердое тело (будут анизотропными). В приведенном на рис. 1.4 примере эту анизотропию можно выявить следующим образом. Проведем из точки О прямые в направлениях О А, OB, ОС и т. д. Число частиц, приходящееся на единицу длины каждого направления, оказывается различным: наиболее густо усеяно частицами направление ОА, наиболее редко - направление ОС. Так как свойства твердого тела в данном направлении определяются в конечном счете плотностью размещения частиц в этом направлении, то становится ясным, что в разных направлениях свойства твердого тела должны быть разными. Зависимость свойств от направления (направленность свойств) называется анизотропией.В качестве примера в табл. 1.1 приведены модули сдвига для кристаллов a-железа, серебра и золота в направлениях [100] и [111],удельное электрическое сопротивление и тепловое расширение кристаллов цинка, сурьмы и теллура в направлениях, параллельном (÷ï) и перпендикулярном (^) оси кристалла.

Таблица 1.1
| Материал | Модуль сдвига, ´105 н/м2 | Материал | Удель. сопротив-ление, ´10-8 ом×м | Теплов. расширение ´10-6 | |||
| [100] | [111] | ֕ | ^ | ֕ | ^ | ||
| a-Fe | Zn | 6,06 | 5,83 | 63,9 | 14,1 | ||
| Ag | Sb | 35,6 | 42,6 | 15,6 | 8,0 | ||
| Au | Te | -1,6 | 27,2 |
Из данных этой таблицы видно, что в зависимости от направления свойства кристалла могут меняться очень сильно.
В заключение данной лекции, рассмотрим различия в физических свойствах монокристаллических и поликристаллических твердых тел.
В специальных условиях твердое тело может вырасти в виде одиночного кристалла - монокристалла. Однако гораздо чаще в расплаве возникает одновременно большое число центров кристаллизации, дающее начало росту большого числа отдельных кристалликов. Разрастаясь, они постепенно сближаются друг с другом, срастаются и образуют цельный конгломерат - поликристалл. Сросшиеся кристаллиты (зерна) имеют обычно форму неправильных полиэдров, внешняя огранка которых совершенно не отражает их правильного внутреннего строения. Так как распределение и ориентация центров кристаллизации в охлаждаемом расплаве совершенно случайны, то и ориентация сросшихся зерен друг относительно друга оказывается также случайной. Поэтому поликристалл не проявляет заметной зависимости свойств от направления - он изотропен.
Кроме того, различие в ориентации срастающихся зерен приводит к возникновению межкристаллитных границ, оказывающих сильное влияние на формирование механических свойств поликристаллического агрегата. Даже в предельно чистом металле, практически не содержащем примесей, кристаллическая решетка в межкристаллитных прослойках искажена. Искажение не ограничивается одним слоем граничных атомов, а простирается на несколько глубинных слоев, с которыми граничные атомы взаимодействуют. Чем больше степень дезориентации граничных зерен, тем шире переходная зона и тем сильнее она искажена.
Искажение кристаллической решетки в межкристаллитных прослойках является причиной локализации в ней избыточного количества свободной энергии. Это подтверждается рядом опытов. Так, Чалмерсом установлено, что для очень чистого олова границы зерен начинают плавиться при несколько более низкой температуре, чем сами зерна. Скорость диффузии по границам зерен больше, чем в объеме. Зарождение новых зерен при рекристаллизации начинается, как правило, на границах старых или в местах, где протекла наиболее интенсивная пластическая деформация, приведшая к нарушению кристаллической решетки. Если металл содержит примеси, то при кристаллизации эти примеси выделяются обычно по границам зерен, что приводит к возникновению межкристаллитных прослоек, по своему составу и свойствам резко отличающихся от самих зерен.
|
из
5.00
|
Обсуждение в статье: Твердые тела (структура и свойства) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

