 |
Главная |
Химические реакции и реагенты
|
из
5.00
|
Глава 4
| химические реакции ОРГАНИЧЕСКих соединений |
Химические реакции и реагенты
Ø Химическая реакция – разрыв старых и образование новых химических связей.
Фактически происходит перераспределение электронов в реакционной системе. Обычно электрон или электронная пара одного компонента реакции переходит на другой компонент.
Для протекания химической реакции необходимо, чтобы реагирующие частицы столкнулись. При этом кинетическая энергия частиц переходит в потенциальную энергию, благодаря которой и осуществляется перераспределение электронов в системе. В определенный момент времени только часть молекул (активированные молекулы) обладает кинетической энергией достаточной для протекания химической реакции. Минимальное количество энергии необходимой для протекания реакции – энергия активации (Еа). Энергия активации необходима реагирующим частицам для образования переходного состояния (активированного комплекса), которое самопроизвольно превращается в продукты реакции. Строго говоря, переходное состояние – это точка на энергетической диаграмме реакции, а активированный комплекс – группировка атомов, соответствующая переходному состоянию.
| исходные молекулы | Û | активированные молекулы | Û | переходное состояние | Û | конечные молекулы |
Чем меньше Еа, тем выше скорость реакции. Повышение температуры реакционной смеси увеличивает количество активированных молекул и, соответственно, повышает скорость реакции.
§ В экзотермических реакциях энергия конечных продуктов меньше энергии исходных соединений. В эндотермических реакциях энергия образуемых соединений выше энергии вводимых в реакцию веществ.
Не следует путать экзотермические и спонтанные (самопроизвольные) реакции. К последним относят процессы, проходящие при комнатной температуре и начинающиеся без затраты дополнительной энергии. Например, реакция горения метана – экзотермическая, но не спонтанная.

Рис. 4.1. Энергетические диаграммы экзотермических (а) и эндотермических (б) реакций
Время существования переходного состояния очень мало – около 10-12 с. Определить строение активированного комплекса непосредственно в реакционной среде невозможно. Обычно его структуру рассматривают как промежуточную меду структурой исходных и конечных молекул. В экзотермических реакциях переходное состояние ближе по энергии к исходным веществам, а значит и активированный комплекс ближе по строению к исходным молекулам. Для эндотермических реакций наоборот структура активированного комплекса ближе к строению конечных веществ.
§ Многие реакции протекают через стадию образования промежуточного продукта – интермедиата (Рис. 4.2а). Время его жизни существенно больше, чем время существования активированного комплекса. Образования многих интермедиатов было зарегистрировано с помощью физических методов, а некоторые наиболее устойчивые промежуточные продукты удается выделить из реакционной смеси. Если в ходе реакции возможно образование нескольких интермедиатов, то реакция идет через переходное состояние с меньшей энергией активации (Рис. 4.2б). Обычно такому переходному состоянию соответствует более устойчивый интермедиат.
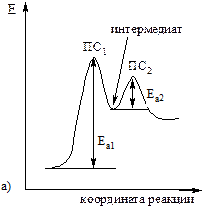

Рис. 4.2. Энергетические диаграммы (а) двухстадийной химической реакции (ПС – переходное состояние); (б) реакции, протекающей с образованием двух интермедиатов
На соотношение продуктов конкурентных реакций влияют как скорости этих реакций, так и термодинамическая устойчивость конечных продуктов. Например, в случае конкурентной реакции В↔А→С (см. Рис. 4.3) при проведении процесса в условиях преодоления обоих энергетических барьеров на начальном этапе будет преимущественно образовываться соединение В, так как для этой реакции меньше Еа и, следовательно, больше скорость реакции. Образование продукта В контролируется кинетически. При длительном проведении реакции преимущественно будет получаться более устойчивый продукт С, т.е. его образование контролируется термодинамически.
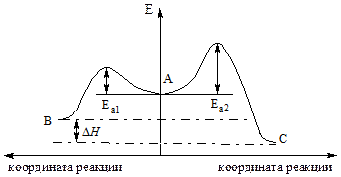
Рис. 4.3. Энергетическая диаграмма конкурентной реакции В↔А→С
v Катализаторы. Значительная часть реакций в органической химии протекает в присутствии катализаторов.
Ø Катализатор – вещество, увеличивающее скорость реакции, но не меняющееся в результате реакции и не входящее в состав ее реагентов или продуктов.
Катализатор понижает энергию активации (Еа*) и увеличивает скорость химической реакции. Действие катализаторов связано с тем, что он направляет реакцию по другому пути, через образование более устойчивых активированных комплексов.

Рис. 4.4. Энергетические диаграммы некатализируемой (а) и катализируемой (б) реакций
§ Различают гомогенный катализ – катализатор растворим в реакционной среде, и гетерогенный катализ – катализатор образует отдельную фазу по отношению к реакционной среде. Гомогенные катализаторы непосредственно взаимодействуют с исходным веществом, а в случае гетерогенных катализаторов обычно происходит адсорбция субстрата или реагента на поверхности катализатора, в результате чего в их структурах происходит активация определенных связей. Примеры гомогенного и гетерогенного катализа будут разобраны в главах, посвященных отдельным классам органических соединений.
§ Широкое применение в органической химии находит межфазный катализ. Реакция проводится в гетерогенной системе «жидкость – жидкость» или «жидкость – твердое тело», в присутствии специальных агентов, способных переносить отдельные компоненты реакционной смеси через границу раздела фаз. Обычно в качестве межфазных катализаторов используют четвертичные аммонийные соли, например, триэтилбензиламмонийхлорид или тетрабутиламмонийгидросульфат, и краун-эфиры (см. Главу 13 «Спирты»).
Рассмотрим принцип действия межфазного катализатора на примере реакции нуклеофильного замещения алкилгалогенидов. Реакцию обычно проводят в системе из двух несмешивающихся жидкостей – полярной и малополярной, например, «вода – бензол» или «вода – метиленхлорид». В этом случае в водной фазе находится неорганический реагент, а в органической фазе – субстрат и конечный продукт. Четвертичная аммонийная соль, способная к обмену анионной компоненты, транспортирует анион нуклеофила из водной фазы в органическую, а также переносит анион уходящей группы из органической фазы в водную.
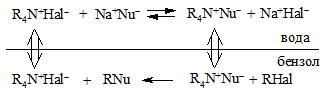
§ В живых организмах действуют чрезвычайно активные и избирательные катализаторы – ферменты. Так, например, фермент уреаза увеличивает скорость реакции гидролиза мочевины в 1014 раз.
v Разрывковалентнойсвязи может протекать двумя способами:
§ гомолитически–параэлектронов ковалентной связи распределяется по одному на каждый атом
А:В → АŸ + ВŸи
§ гетеролитически– электронная пара отходит к одному более электроотрицательному атому
А:В → А- + В+.
§ Перициклические реакции – отдельный тип реакций, в которых разрыв старых и образование новых связей происходит согласовано через циклическое переходное состояние. К таким процессам, в частности, относятся реакции циклоприсоединения.
· Свободные радикалы. В первом случае образуются высокореакционные малоустойчивыесвободные радикалы– частицы с неспаренным валентным электроном(в общем виде обозначают RŸ). Соответствующие реакции называют радикальными.
При рассмотрении отдельных классов органических соединений будут рассмотрены реакции, протекающие с участием свободных радикалов галогенов ClŸ или BrŸ, гидропероксильных и алкилпероксильных радикалов НООŸ и ROOŸ, различных углеводородных RŸ и ацильных RСOŸ радикалов. Большинство свободных радикалов – малоустойчивые и короткоживущие частица, но некоторые из них, например, трифенилметильный или 2,6-ди-трет-бутилфеноксильный радикалы, относительно стабильны.

· Нуклеофилыи электрофилы. При гетеролитическом разрыве ковалентной связи образуются ионы, а подобные реакции называют ионными. Реакционные частицы, у которых положительный и отрицательный заряды находятся на атоме углерода, называют, соответственно, карбкатионикарбанион. В общем случае частицу с дробным или целым положительным зарядом называют электрофил (в общем виде обозначают Е или E+), а с отрицательным зарядом – нуклеофил (в общем виде обозначают :Nu или Nu-).
Ø Нуклеофилы – частицы с электрондонорными свойствами, способными отдавать пару электронов на образование ковалентной связи с электрофильной компонентой.
К нуклеофилам относят:
| § анионы, включая карбанионы, | Н-, НО-, HS-, Hal-, HCºC- |
| § нейтральные соединения с атомами, имеющими неподеленные пары электронов, | 
|
| § нейтральные соединения с сильно полярной связью, | 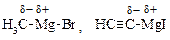
|
| § углеводороды с p-электронными системами. | 
|
Ø Электрофилы – частицы с электронакцепторными свойствами, способные образовывать ковалентную связь с нуклеофильной компонентой за счет ее электронной пары.
К электрофилам относят:
| § катионы, включая карбкатионы, | Н+, Br+, NO2+, ArN2+, R3C+ |
| § нейтральные соединения с атомами, имеющими незаполненную орбиталь, | BF3, BR3, FeBr3, AlCl3 |
| § нейтральные соединения с сильно полярной связью, | 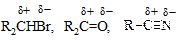
|
| § нейтральные легко поляризующиеся соединения. | Cl2, Br2, I2 |
v Основные типы реакций. В соответствии с характером химических превращений выделяют несколько типов химических реакций, в том числе:
| § реакции присоединения (обозначают А от англ. addition) | A + B = C | CH2=CH2 + Cl2 → CH2Cl-CH2Cl |
| § реакции замещения (обозначают S от англ. substitution) | AX + BY = AB + XY | CH3Br + AgOH → CH3OH + AgBr |
| § реакции отщепления (обозначают Е от англ. elimination) | A = B + C | CH3CH2OH → CH2=CH2 + H2O |
| § реакции циклоприсоединения | 
| 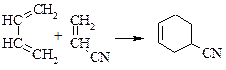
|
| § кислотно-основные реакции | АН + :В = А- + ВН+ | HCl + NH2CH3 → CH3NH3+ Cl- |
| § реакции изомеризации и перегруппировки | А=В-С → А-В=С

| 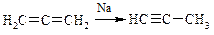

|
v Окислительно-восстановительные реакции. В органической химии широкое распространение имеют окислительно-восстановительные процессы, в ходе которых меняется степень окисления атома углерода или других атомов, входящих в молекулу. В общем виде процесс окисления включает перенос электронов от субстрата на реагент-окислитель, а восстановление – наоборот, переход электронов на субстрат от реагента-восстановителя. Для органических соединений, обычно, окисление связано с отщеплением атомов водорода и образованием кратных связей или заменой связей с атомом водорода на связи с атомом кислорода или другими более электроотрицательными, чем атом водорода, атомами. Соответственно, восстановление обусловлено как присоединением атомов водорода по кратным связям, так и заменой гетероатомов на атомы водорода.
Примеры рядов окисления-восстановления по атомам углерода и азота.

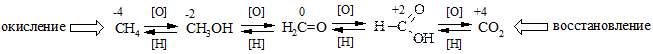

v Молекулярность реакции определяется по количеству частиц необходимых для образования активированного комплекса. Наиболее распространены мономолекулярные и бимолекулярные реакции. Примерами мономолекулярных реакций могут послужить реакции нуклеофильного замещения, протекающие по механизму SN1 (см. Главу 12 «Галогенпроизводные углеводородов»), и реакции элиминирования, проходящие по механизму Е1 (см. Главу 8 «Алкены»).
К бимолекулярным реакциям, в частности, относятся реакции галогенирования алкенов и реакции нуклеофильного замещения и отщепления, осуществляемые по механизмам SN2 и Е2 соответственно.
В качестве примера тримолекулярной реакции можно рассмотреть присоединение галогеноводородов к алкенам (см. Главу 8 «Алкены»).
v Понятиео механизме реакции. Многие реакции идут в несколько стадий через цепочку превращений. Последовательность таких превращений, включающая все промежуточные продукты реакции (интермедиаты) называют механизмом реакции.
Любой механизм органической реакции является в определенной степени гипотетическим. Даже относительно небольшие изменения в структуре субстрата и реагента или условий протекания реакции могут принципиально изменить механизм реакции, например, реакция гидробромирования алкенов может протекать как ионное присоединение через образование карбкатиона, согласованное трехмолекулярное присоединение или свободнорадикальное присоединение (см. Главу 8 «Алкены»). Обычно в процессе установления механизма конкретной реакции учитываются данные кинетических исследований, пространственного строения исходных и конечных продуктов, структуре интермедиатов.
Важную роль в описании механизма реакции играет атакующая частица (радикал, нуклеофил, электрофил). Тип частицы часто указывают при классификации реакций, например:
| § радикальное замещение (SR) | CH4 + Cl2 → CH3Cl + HCl |
| § нуклеофильное замещение (SN) | CH3Br + AgOH → CH3OH + AgBr |
| § электрофильное замещение (SE) | 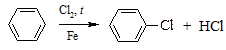
|
Отнесение реакций к нуклеофильным или электрофильным часто весьма условно. Например, в приведенной ниже реакции атом углерода в алкилгалогениде является электрофильным, а атом азота в метиламине, соответственно, – нуклеофильным. Поэтому эту реакцию можно рассматривать как нуклеофильное замещение галогена на аминогруппу, так и как процесс электрофильного замещения по атому азота.
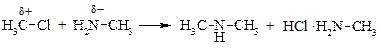
|
из
5.00
|
Обсуждение в статье: Химические реакции и реагенты |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

