 |
Главная |
Активность металлов и неметаллов
|
из
5.00
|
Для анализа активности металлов используют либо электрохимический ряд напряжений металлов, либо их положение в Периодической таблице. Чем активнее металл, тем легче он будет отдавать электроны и тем более хорошим восстановителем он будет в окислительно-восстановительных реакциях.
Электрохимический ряд напряжений металлов.
| Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H Sb Bi Cu Hg Ag Pd Pt Au |
Активность неметаллов так же можно определить по их положению в таблице Менделеева.
Запомните! Азот — более активный неметалл, чем хлор!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!
Более активный неметалл будет окислителем, а менее активный будет довольствоваться ролью восстановителя, если они реагируют друг с другом.
Ряд электроотрицательности неметаллов:
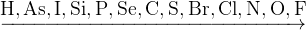
|
| увеличение электроотрицательности |
Особенности поведения некоторых окислителей и восстановителей.
а) кислородсодержащие соли и кислоты хлора в реакциях с восстановителями обычно переходят в хлориды:
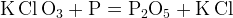
б) если в реакции участвуют вещества, в которых один и тот же элемент имеет отрицательную и положительную степени окисления — они встречаются в нулевой степени окисления (выделяется простое вещество).

Необходимые навыки.
1. Расстановка степеней окисления.
Необходимо помнить, что степень окисления — это гипотетический заряд атома (т.е. условный, мнимый), но он должен не выходить за рамки здравого смысла. Он может быть целым, дробным или равным нулю.
Задание 1:Расставьте степени окисления в веществах:


2. Расстановка степеней окисления в органических веществах.
Помните, что нас интересуют степени окисления только тех атомов углерода, которые меняют своё окружение в процессе ОВР, при этом общий заряд атома углерода и его неуглеродного окружения принимается за 0.
Задание 2:Определите степень окисления атомов углерода, обведённых рамкой вместе с неуглеродным окружением:
2-метилбутен-2: 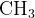 –
–  =
= 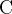
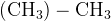
ацетон: 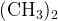
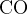
уксусная кислота: 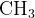 –
– 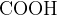
3. Не забывайте задавать себе главный вопрос: кто в этой реакции отдаёт электроны, а кто их принимает, и во что они переходят? Чтобы не получалось, что электроны прилетают из ниоткуда или улетают в никуда.
Пример: 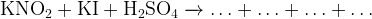
В этой реакции надо увидеть, что иодид калия 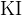 может являться только восстановителем, поэтому нитрит калия
может являться только восстановителем, поэтому нитрит калия 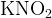 будет принимать электроны, понижая свою степень окисления.
будет принимать электроны, понижая свою степень окисления.
Причём в этих условиях (разбавленный раствор) азот переходит из  в ближайшую степень окисления
в ближайшую степень окисления  .
.

4. Составление электронного баланса сложнее, если формульная единица вещества содержит несколько атомов окислителя или восстановителя.
В этом случае это необходимо учитывать в полуреакции, рассчитывая число электронов.
Самая частая проблема — с дихроматом калия 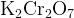 , когда он в роли окислителя переходит в
, когда он в роли окислителя переходит в  :
:

Эти же двойки нельзя забыть при уравнивании, ведь они указывают число атомов данного вида в уравнении.
Задание 3:Какой коэффициент нужно поставить перед 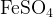 и перед
и перед 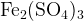

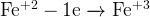
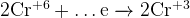
Задание 4:Какой коэффициент в уравнении реакции будет стоять перед магнием?

5. Определите, в какой среде (кислой, нейтральной или щелочной) протекает реакция.
Это можно сделать либо про продуктам восстановления марганца и хрома, либо по типу соединений, которые получились в правой части реакции: например, если в продуктах мы видим кислоту, кислотный оксид — значит, это точно не щелочная среда, а если выпадает гидроксид металла — точно не кислая. Ну и разумеется, если в левой части мы видим сульфаты металлов, а в правой — ничего похожего на соединения серы — видимо, реакция проводится в присутствии серной кислоты.
Задание 5:Определите среду и вещества в каждой реакции:
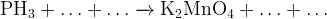

6. Помните, что вода — вольный путешественник, она может как участвовать в реакции, так и образовываться.
Задание 6:В какой стороне реакции окажется вода? Bо что перейдёт цинк?
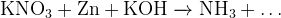
Задание 7:Мягкое и жесткое окисление алкенов.
Допишите и уравняйте реакции, предварительно расставив степени окисления в органических молекулах:
 (хол. р-р.)
(хол. р-р.) 
 (водн.р-р) (водн.р-р) 
| ||
7. Иногда какой-либо продукт реакции можно определить, только составив электронный баланс и поняв, каких частиц у нас больше:
Задание 8:Какие продукты ещё получатся? Допишите и уравняйте реакцию:
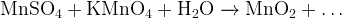
8. Во что переходят реагенты в реакции?
Если ответ на этот вопрос не дают выученные нами схемы, то нужно проанализировать, какие в реакции окислитель и восстановитель — сильные или не очень?
Если окислитель средней силы, вряд ли он может окислить, например, серу из  в
в  , обычно окисление идёт только до
, обычно окисление идёт только до  .
.
И наоборот, если 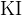 — сильный восстановитель и может восстановить серу из
— сильный восстановитель и может восстановить серу из  до
до  , то
, то  — только до
— только до  .
.
Задание 9:Во что перейдёт сера? Допишите и уравняйте реакции:

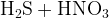 (конц.)
(конц.) 
9. Проверьте, чтобы в реакции был и окислитель, и восстановитель.
Задание 10:Сколько ещё продуктов в этой реакции, и каких?

10. Если оба вещества могут проявлять свойства и восстановителя, и окислителя — надо продумать, какое из них более активный окислитель. Тогда второй будет восстановителем.
Задание 11:Кто из этих галогенов окислитель, а кто восстановитель?

11. Если же один из реагентов — типичный окислитель или восстановитель — тогда второй будет «выполнять его волю», либо отдавая электроны окислителю, либо принимая у восстановителя.
Пероксид водорода — вещество с двойственной природой, в роли окислителя (которая ему более характерна) переходит в воду, а в роли восстановителя — переходит в свободный газообразный кислород.
Задание 12:Какую роль выполняет пероксид водорода в каждой реакции?
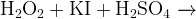
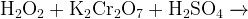
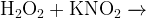
Последовательность расстановки коэффициентов в уравнении.
Сначала проставьте коэффициенты, полученные из электронного баланса.
Помните, что удваивать или сокращать их можно только вместе. Если какое-либо вещество выступает и в роли среды, и в роли окислителя (восстановителя) — его надо будет уравнивать позднее, когда почти все коэффициенты расставлены.
Предпоследним уравнивается водород, а по кислороду мы только проверяем!
1. Задание 13:Допишите и уравняйте:

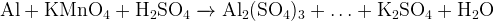
Не спешите, пересчитывая атомы кислорода! Не забывайте умножать, а не складывать индексы и коэффициенты.
Число атомов кислорода в левой и правой части должно сойтись!
Если этого не произошло (при условии, что вы их считаете правильно), значит, где-то ошибка.
Возможные ошибки.
1. Расстановка степеней окисления: проверяйте каждое вещество внимательно.
Часто ошибаются в следующих случаях:
а) степени окисления в водородных соединениях неметаллов: фосфин  — степень окисления у фосфора — отрицательная;
— степень окисления у фосфора — отрицательная;
б) в органических веществах — проверьте ещё раз, всё ли окружение атома  учтено;
учтено;
в) аммиак и соли аммония — в них азот всегда имеет степень окисления  ;
;
г) кислородные соли и кислоты хлора — в них хлор может иметь степень окисления 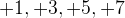 ;
;
д) пероксиды и надпероксиды — в них кислород не имеет степени окисления  , бывает
, бывает 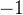 , а в
, а в  — даже
— даже  ;
;
е) двойные оксиды:  — в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
— в них металлы имеют две разные степени окисления, обычно только одна из них участвует в переносе электронов.
Задание 14:Допишите и уравняйте:
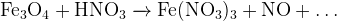
Задание 15:Допишите и уравняйте:

2. Выбор продуктов без учёта переноса электронов — то есть, например, в реакции есть только окислитель без восстановителя или наоборот.
Пример: в реакции  свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса…
свободный хлор часто теряется. Получается, что электроны к марганцу прилетели из космоса…
3. Неверные с химической точки зрения продукты: не может получиться такое вещество, которое вступает во взаимодействие со средой!
а) в кислой среде не может получиться оксид металла, основание, аммиак;
б) в щелочной среде не получится кислота или кислотный оксид;
в) оксид или тем более металл, бурно реагирующие с водой, не образуются в водном растворе.
Задание 16:Найдите в реакциях ошибочные продукты, объясните, почему они не могут получаться в этих условиях:

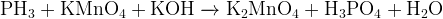

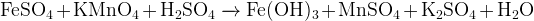
Ответы и решения к заданиям с пояснениями.
Задание 1:



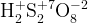
Задание 2:
2-метилбутен-2: 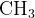 –
–  =
= 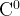
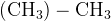
ацетон: 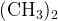
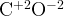
уксусная кислота: 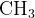 –
– 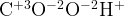
Задание 3:
Так как в молекуле дихромата 2 атома хрома, то и электронов они отдают в 2 раза больше — т.е. 6.

Задание 4:
Так как в молекуле  два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент
два атома азота, эту двойку надо учесть в электронном балансе — т.е. перед магнием должен быть коэффициент  .
.

Задание 5:
Если среда щелочная, то фосфор 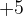 будет существовать в виде соли — фосфата калия.
будет существовать в виде соли — фосфата калия.

Если среда кислая, то фосфин переходит в фосфорную кислоту.

Задание 6:
Так как цинк — амфотерный металл, в щелочном растворе он образует гидроксокомплекс. В результате расстановки коэффициентов обнаруживается, что вода должна присутствовать в левой части реакции:

Задание 7:
Электроны отдают два атома  в молекуле алкена. Поэтому мы должны учесть общее количество отданных всей молекулой электронов:
в молекуле алкена. Поэтому мы должны учесть общее количество отданных всей молекулой электронов:
 (хол. р-р.)
(хол. р-р.) 
Обратите внимание, что из 10 ионов калия 9 распределены между двумя солями, поэтому щелочи получится только одна молекула.
Задание 8:

В процессе составления баланса мы видим, что на 2 иона  приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
приходится 3 сульфат-иона. Значит, помимо сульфата калия образуется ещё серная кислота (2 молекулы).
Задание 9:

(перманганат не очень сильный окислитель в растворе; обратите внимание, что вода переходит в процессе уравнивания вправо!)
 (конц.)
(конц.) 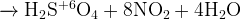
(концентрированная азотная кислота очень сильный окислитель)
Задание 10:
Не забудьте, что марганец принимает электроны, при этом хлор их должен отдать.
Хлор выделяется в виде простого вещества.
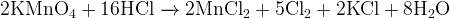
Задание 11:
Чем выше в подгруппе неметалл, тем более он активный окислитель, т.е. хлор в этой реакции будет окислителем. Йод переходит в наиболее устойчивую для него положительную степень окисления 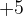 , образуя йодноватую кислоту.
, образуя йодноватую кислоту.
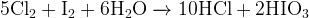
Задание 12:
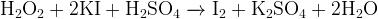
(пероксид — окислитель, т.к. восстановитель — 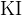 )
)

(пероксид — восстановитель, т.к. окислитель — перманганат калия)

(пероксид — окислитель, т.к. роль восстановителя более характерна для нитрита калия, который стремится перейти в нитрат)
Задание 13:

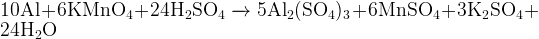
Задание 14:
В молекуле 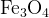 из трех атомов железа только один имеет заряд
из трех атомов железа только один имеет заряд  . Он окислится в
. Он окислится в  .
.

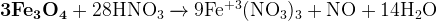
Задание 15:
Общий заряд частицы 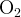 в надпероксиде калия
в надпероксиде калия  равен
равен 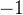 . Поэтому он может отдать только
. Поэтому он может отдать только 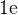 .
.

Задание 16:
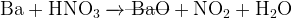 (водный раствор)
(водный раствор)
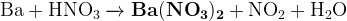
(щелочная среда)
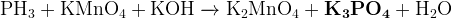
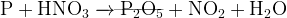 (водный раствор)
(водный раствор)
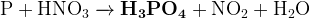
(кислая среда)
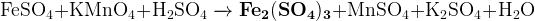
|
из
5.00
|
Обсуждение в статье: Активность металлов и неметаллов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

