 |
Главная |
Определение общей жесткости воды
|
из
5.00
|
Лабораторная работа №15
Тема:Приготовление и стандартизация раствора трилона Б.Определение общей жесткости воды.
Цель работы:научиться приготавливать раствор трилона Б и стандартизировать его, определять общую жесткость воды
Общие положения
Химическая формула трилона Б (кислой натриевой соли этилендиаминтетрауксусной кислоты) – Na2H2C10H12O8N2 ∙2H2O (сокращенно – Na2H2Y). Молярная масса составляет 372,30 г/моль. Число эквивалентов равно 2 (независимо от степени окисления катионов металла). Следовательно, молярная масса эквивалента трилона Б равна 1/2 моль, т.е. 186,15 г/моль. Для работы чаще всего используют растворы с молярной концентрацией эквивалента 0,01 – 0,1 моль/дм3.
Общая жесткость воды показывает содержание миллимоль гидрокарбонатов, сульфатов, хлоридов кальция и магния в 1 л воды.
Методика выполнения лабораторного исследования
И оформление отчета
1. Приготовление раствора трилона Б:
Для приготовления 100 мл раствора трилона Б, имеющего молярную концентрацию эквивалента 0,1 моль/дм3, необходимо взять навеску m тр.Б г, рассчитанную по следующей формуле:
m тр.Б =Nтр.Б ∙ Этр.Б ∙ Vтр.Б = 0,1∙186,15∙0,1 = _______ г
где Nтр.Б – молярная концентрация эквивалента раствора трилона Б, моль/дм3,
Этр.Б – молярная масса эквивалента трилона Б, г/моль,
Vтр.Б – объем приготовляемого раствора трилона Б, мл.
Рассчитанную навеску или близкую к ней по массе точно взвешивают на аналитических весах, переносят через воронку в мерную колбу объемом 100 мл. Пустую пробирку, после пересыпания навески, снова взвешивают на аналитических весах. Оформляют результаты взвешивания следующим образом:
mнавески расчетная =
mпробирки на технических весах =
mпробирки с навеской на технических весах =
mпробирки с навеской на аналитических весах =
mпробирки на аналитических весах =
mточная навески =
Дистиллированной водой доводят объем раствора в мерной колбе до метки, предварительно полностью растворив навеску. Колбу плотно закрывают и тщательно перемешивают.
Рассчитывают титр приготовленного раствора Ттр.Б г/см3, по следующей формуле:
Ттр.Б =  =
=
где mнавески – масса точная навески трилона Б, г,
Vколбы – объем мерной колбы для приготовления раствора, мл.
Далее рассчитываем нормальность приготовленного раствора Nтр.Б моль/дм3, по формуле:
Nтр.Б = 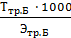 =
=
где Ттр.Б – титр приготовленного раствора трилона Б, г/см3,
Этр.Б – молярная масса эквивалента трилона Б, г/моль.
Титр приготовленного раствора проверяют методом пипетирования по стандартному раствору сульфата магния (х.ч.), приготовленному из фиксанала. Молярная концентрация эквивалента раствора сульфата магния - 0,1 моль/дм3.
Титрование:
Пипеткой на 10 мл отбирают в 3 конические колбы для титрования приготовленный из фиксанала раствор сульфата магния. Затем в каждую колбу добавляют 5 мл раствора аммонийно-буферной смеси (отмеривают мерным цилиндром) и 3-4 капли спиртового раствора индикатора кислотного хрома темно-синего. Раствор окрасится в винно-красный цвет вследствие образования комплексного соединения индикатора с катионами магния.
Раствор в колбах титруют приготовленным раствором трилона Б (его заливают в бюретку) при тщательном перемешивании до перехода винно-красной окраски в сине-фиолетовую.
Для точного установления точки эквивалентности в титруемый раствор добавляют еще 1 каплю трилона Б. Появление синей окраски свидетельствует о конце титрования и о полном связывании катионов Mg2+ в прочное внутрикомплексное соединение Na2[MgY]. Титрование проводят 3 раза и находят средний объем трилона Б.
Расчеты:
Молярную концентрацию эквивалента трилона Б N(Nа2Н2Y) моль/дм3, вычисляют по формуле:
N(Nа2Н2Y) · V(Nа2Н2Y) = N(MgSО4) · V(MgSО4)
где V(Nа2Н2Y) – объем трилона Б, пошедший на титрование, мл,
N(MgSО4) – молярная концентрация эквивалента раствора магний сульфата, моль/дм3,
V(MgSО4) – аликвотный объем раствора сульфата магния, мл.
Выразив из этой формулы N(Nа2Н2Y), получаем:
N(Nа2Н2Y) = N(MgSО4) · V(MgSО4) / V(Nа2Н2Y) =
Расчет титра трилона Б Т(Nа2Н2Y) г/см3, производим по следующей формуле:
Т(Nа2Н2Y) = N(Nа2Н2Y) · М(1/2Nа2Н2Y) / 1000 =
где N(Nа2Н2Y) - молярная концентрация эквивалента раствора трилона Б, моль/дм3,
М(1/2Nа2Н2Y) - молярная масса эквивалента трилона Б, г/моль.
Результаты анализа сводят в таблицу:
| Величина | Значение |
| Объем раствора MgSО4, см3 | |
| Объем раствора трилона Б, см3 1-е титрование 2-е титрование 3-е титрование | |
| Средний объем раствора трилона Б, см3 | |
| N(MgSО4), моль/дм3 | |
| N(Nа2Н2Y), моль/дм3 | |
| Т(Nа2Н2Y), г/см3 |
Определение общей жесткости воды.
В коническую колбу на 250 мл вносят 100 мл исследуемой воды, отмеренной мерной колбой (мутную воду предварительно фильтруют).
Затем прибавляют 5 мл аммонийно-буферной смеси, 5-7 капель спиртового раствора индикатора кислотного хрома темно-синего и титруют раствором трилона Б. К концу титрования раствор трилона Б прибавляют по каплям, тщательно встряхивая смесь в колбе. Титрование продолжают до изменения вишнево-красной окраски раствора в фиолетовую и от одной капли – в синюю.
Определение проводят три раза. Результаты заносят в таблицу 1. Если на титрование 100 мл воды расходуется больше 5 мл раствора трилона Б с N(Nа2Н2Y) = 0,1моль/дм3, то это указывает, что в отмеренном объеме воды суммарное содержание кальция, магния больше 0,5 ммоль/л.
В таких случаях определение следует повторить, взяв меньший объем воды и разбавив его в мерной колбе до 100 мл дистиллированной водой.
Нечеткое изменение окраски раствора в точке эквивалентности указывает на присутствие в воде катионов Cu2+, Zn2+, Mn2+, мешающих определению. Для устранения влияния мешающих катионов к отмеренной для титрования пробе воды прибавляют 1-2 мл раствора сульфида натрия с массовой доле й Na2S = 1,5 – 2%. После этого, не отделяя осадка сульфидов меди (II), цинка, марганца (II), проводят титрование раствором трилона Б.
Расчет:
Общую жесткость воды Жо мг-экв/л, вычисляют по следующей формуле:
Жо = NNа2Н2Y · VNа2Н2Y · 1000 =
100
где NNа2Н2Y – нормальность трилона Б, моль/дм3,
VNа2Н2Y – объем трилона Б, израсходованного на титрование, мл,
100 – объем воды, взятый на титрование, мл;
1000 – 1 л воды, в котором определяют жесткость воды.
Результаты определения свести в таблицу.
Таблица
| Величина | Значение |
| Объем мерной колбы, мл | |
| Объем раствора трилона Б, см3 1-е титрование 2-е титрование 3-е титрование | |
| Средний объем раствора трилона Б, см3 | |
| N(Nа2Н2Y), моль/дм3 | |
| Общая жесткость воды, мг-экв/л |
Контрольные вопросы:
1. Перечислите известные вам комплексоны.
2. Объясните сущность метода комплексонометрии.
3. Объясните сущность методики общей жесткости воды.
4. Опишите условия титрования трилона Б.
5. Объясните, как фиксируется точка эквивалентности в комплексонометрии.
6. Объясните, что показывает общая жесткость воды.
7. Составьте уравнения реакций, характеризующих общую жесткость воды.
8. Установите преимущества метода комплексонометрии перед другими методами титриметрического анализа.
9. Составьте уравнение реакции, протекающей между трилоном Б и сульфатом магния.
10. Обоснуйте необходимость добавления аммонийно-буферной смеси к титруемому раствору в методе комплексонометрии.
11. Приведите способы расчета титра и нормальности трилона Б.
Список литературы:
1. Жванко, Ю. Н. Аналитическая химия и технохимический контроль в общественном питании / Ю. Н. Жванко, Г. В. Панкратова, З. И. Мамедова. – М.: Высшая школа, 1980. – с. 114 – 118.
2. Шапиро, М. А. Аналитическая химия: учебник / М. А. Шапиро, С. А. Шапиро. – М.: Высшая школа, 1979. – с.279 – 281.
|
из
5.00
|
Обсуждение в статье: Определение общей жесткости воды |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

