 |
Главная |
Например, абсолютная масса молекулы серной кислоты равна
|
из
5.00
|
Основные понятия химии
1. Физические явления – это явления, при которых изменяется форма или агрегатное состояние вещества, но не меняется его состав и строение, а, следовательно, и химические свойства. Например, вода при 100 0С переходит в газообразное состояние (пар), а при 0 0С превращается в твёрдое состояние (лёд). Нагревание и охлаждение воды изменяют только её агрегатное состояние, но не нарушают химической связи между атомами водорода и кислорода.
2. Химические явления – это явления, при которых одни вещества превращаются в другие, отличающиеся от исходных своим составом, строением и свойствами. Например, если воду подвергнуть электролизу, то получим два газообразных вещества – водород и кислород, которые отличаются от воды физическими и химическими свойствами.
Химические явления иначе называются химическими превращениями или химическими реакциями. Исходные вещества, которые вступают в химическую реакцию, называются реагентами, а образующиеся новые вещества – продуктами реакции.
3. Основные положения атомно-молекулярного учения.
Колыбелью атомно-молекулярного учения является Древняя Греция. Атомистика, развитая Левкиппом, Демокритом и Эпикуром, была просто гениальной догадкой, смелым предположением, филисофской концепцией, но не подтвержденной практикой. Это привело к тому, что одна из гениальных догадок человеческого разума постепенно была предана забвению. Об учении атомистов не вспоминали почти 20 веков. И только к концу XVIII, началу XIX века атомно-молекулярное учение было воссоздано, т.е. к тому времени, когда в химию были введены количественные методы исследования. Огромный вклад в развитие этой теории внес великий русский ученый М. В. Ломоносов (1741 г). Основные положения этой теории заключаются в следующем:
а)Вещества состоят из молекул; молекулы различных веществ отличаются между собой размерами, массой, составом, строением, физическими и химическими свойствами.
б) Молекулы состоят из атомов. Атомы характеризуются определёнными размерами, массой, строением и свойствами. Свойства атомов одного и того же элемента одинаковы и отличаются от свойств атомов других элементов. При химических реакциях атомы в отличие от молекул не претерпевают качественных изменений.
в) Молекулы и атомы находятся в непрерывном движении; между ними существует взаимное притяжение и отталкивание. Скорость движения молекул зависит от агрегатного состояния вещества.
г) При физических явлениях состав молекул остаётся неизменным; при химических явлениях молекулы претерпевают качественные и количественные изменения, т. е. молекулы одних веществ превращаются в молекулы других веществ.
Через 67 лет после Ломоносова (1808 г) атомистическое учение в химии применил английский учёный Дальтон и развил его дальше. Атомно-молекулярное учение в химии окончательно утвердилось лишь в середине XIX века. На международном съезде химиков в 1860 г. были приняты определения атома и молекулы.
4. Атом – это наименьшая электронейтральная частица химического элемента, сохраняющая его химические свойства и состоящая из положительно заряженного ядра и отрицательно заряженных электронов.
Атом является пределом химической делимости материи. Они могут взаимодействовать между собой, образуя молекулы.
5. Молекула – это наименьшая частица вещества, обладающая его химическими свойствами и способная к устойчивому самостоятельному существованию.
Способность к устойчивому самостоятельному существованию является свойством большинства молекул, но не обязательным их признаком. Так, например, угольная кислота Н2СО3 к устойчивому самостоятельному существованию не способна, однако с химической точки зрения именно эта молекула является основой для образования всех производных угольной кислоты.
Не все вещества состоят из молекул. Известно много веществ немолекулярного строения, к ним относятся ионные или атомные кристаллы.
6. Химический элемент – это отдельный вид атомов с одинаковым положительным зарядом ядра. Химические свойства элемента определяются строением его атомов.
7. Простые и сложные вещества. Вещества, молекулы которых состоят из атомов одного элемента, называются простыми (H2, O2, Cu, S и т.д.). Простых веществ известно свыше 400. Сложные вещества (химические соединения) – это вещества, молекулы которых состоят из атомов разных элементов (H2O, H2SO4, NaCl и т. д.).
Между понятиями «простое вещество» и «химический элемент» существует различие. Любое простое вещество характеризуется строго определенной совокупностью признаков – цветом, формой кристаллов, плотностью, температурой кипения, плавления и т. д. Этими и другими признаками простые вещества отличаются между собой.
Свойства же химического элемента определяются признаками отдельных атомов, в первую очередь – зарядом ядра.
8. Аллотропия – это способность химического элемента образовывать несколько простых веществ. Сами же простые вещества, которые образованы одним элементом, называются аллотропными видоизменениями или модификациями. Аллотропия обусловлена двумя причинами:
а) различным числом атомов в молекуле (например, элемент кислород образует две аллотропные модификации – кислород O2 и озон O3);
б) образованием различных кристаллических форм (например, алмаз и графит).
9. Химическая формула – это условное обозначение состава молекулы вещества с помощью символов химических элементов. Цифры в формулах называются индексами. Индекс показывает число атомов каждого элемента в молекуле вещества. Различают несколько видов химических формул: эмпирические (простейшие), молекулярные (истинные) и структурные (графические).
Химические формулы, указывающие только на соотношение атомов в молекуле, называют эмпирическими или простейшими.
Химические формулы, указывающие истинное число атомов в молекуле, называют молекулярными.
Химические формулы, указывающие порядок относительного расположения атомов в молекуле, называют структурными.
Каждое вещество имеет свою химическую формулу. По формуле вещества можно рассчитывать массовую долю каждого химического элемента, который входит в состав вещества. Массовая доля элемента Х (в %) – это отношение относительной атомной массы данного элемента, умноженной на число его атомов в молекуле, к относительной молекулярной массе вещества
Ar (X)×n
w (X) = ¾¾¾¾ ×100 %,
Mr
где w (X) – массовая доля элемента X в формуле данного вещества; Ar (X) – относительная атомная масса элемента X; n – число атомов элемента X в молекуле вещества; Мr – относительная молекулярная масса вещества.
10. Химическое уравнение – это выражение химической реакции с помощью химических формул веществ. Химические уравнения составляют таким образом, чтобы число атомов каждого элемента в левой и правой частях уравнения было одинаковым. Для этого перед формулами веществ ставят коэффициенты. Они показывают число молекул или молей каждого вещества, которое участвует в реакции.
11. Валентность – это свойство атомов данного элемента образовывать определённое число химических связей с атомами других элементов в молекуле. Обозначают валентность римскими цифрами над символом элемента. За единицу валентности принимается валентность атома водорода. Поэтому в водородном соединении валентность элемента равна числу атомов водорода, которые присоединяет атом данного элемента. Например, в соединениях HCl, H2O, PH3, CH4 валентность хлора – I, кислорода – II, фосфора – III, углерода – IV.
Многие элементы не образуют соединений с водородом, но образуют их с кислородом. Кислород в соединениях всегда двухвалентен. Так, в оксидах Na2O, CaO, Fe2O3 валентность натрия, кальция и железа соответственно равны I, II и III.
Существуют элементы с постоянной и переменной валентностью. Элемент с постоянной валентностью – это элемент, который во всех соединениях имеет одинаковую валентность. Элемент с переменной валентностью – это элемент, который в разных соединениях имеет разную валентность.
Для бинарных соединений (AmBn) существует правило валентности: произведение валентности на число атомов одного элемента (А) равно произведению валентности на число атомов другого элемента (В).
Правило валентности позволяет:
- определить валентность элементов по формулам их соединений;
- составлять формулы бинарных соединений по валентности элементов.
12. Относительная атомная масса (Ar).Второй важной характеристикой атома после заряда ядра является его относительная атомная масса. Истинная масса атома элемента называется абсолютной атомной массой (mA). Массы атомов очень малы. Например,
mA (H) = 1,67×10-24 г,
mA (O) = 2,66×10-23 г,
mA (C) = 1,99×10-23 г.
Пользоваться такими числами при различных расчётах крайне неудобно. Поэтому в химии обычно используют не абсолютные, а относительные значения масс атомов. Понятие атомной массы претерпело длительную эволюцию. Вначале химики в течение почти 100 лет пользовались водородной единицей атомных масс. Затем была введена кислородная единица, равная 1/16 массы атома кислорода. Она была общепринятой с 1906 по 1961 г. В 1961 г. Международный союз по чистой и прикладной химии (IUPAC) принял новую единицу измерения атомных масс – атомную единицу массы. Углеродная единица (у.е) или атомная единица массы (а.е.м.) – это 1/12 массы атома изотопа углерода с массовым числом 12 (12C):
1 а.е.м. = 1/12 mA (12C) = 1,66×10-24 г.
Эта единица создает единую основу для химических и физических расчетов.
Относительная атомная масса (Ar) – это масса атома, выраженная в атомных единицах массы. Ar – это число, показывающее, во сколько раз масса атома данного элемента тяжелее 1/12 массы атома изотопа углерода 12C. Величина Ar безразмерна.
Между абсолютной и относительной атомными массами элемента X существует соотношение, выражаемое формулой
mA (X)
mA (X) = Ar (X)×1 а.е.м. или Ar (X) = ¾¾¾¾¾
1/12 mA (12C)
где mA (X) – масса атома данного элемента, mA (12C) – масса атома углерода.
Относительная атомная масса – одна из основных характеристик химического элемента. Их значения приведены в периодической системе химических элементов Д.И.Менделеева. Например, Ar (Fe) = 56 а.е.м. Это значит, что атом элемента железа в 56 раз тяжелее 1/12 массы атома углерода. Абсолютная масса атома железа будет равна: 56×1,66×10-24 = 92,96×10-24 г.
Приблизительные величины атомных масс (для тяжелых элементов) можно определить, исходя из правила Дюлонга и Пти: произведение удельной теплоёмкости простого вещества в твердом состоянии на атомную массу элемента при средних температурах равно приблизительно 6,38.
Атомные массы с точностью до 0,1 находят методом определения эквивалентов. Современные физические методы (масс-спектроскопия) позволяют определять относительные массы атомов с точностью до 0,001 и даже до 0,00001.
Современные значения атомных масс в углеродной шкале приведены в периодической системе элементов Д.И. Менделеева. Обычно для расчетов используют округленные значения относительных масс.
13.Относительная молекулярная масса (Mr) – это масса молекулы вещества, выраженная в атомных единицах массы. Mr – это число, показывающее, во сколько раз масса молекулы данного вещества тяжелее 1/12 массы атома изотопа углерода 12С. Величина Mr безразмерна.
Относительная молекулярная масса молекул простых и сложных веществ равна сумме относительных атомных масс атомов, входящих в состав молекул.
Между абсолютной и относительной молекулярными массами вещества X существует соотношение, выражаемое формулой
mM (X)
mM (X) = Mr (X)×1 а.е.м. или Mr (X) = ¾¾¾¾¾
1/12 mA (C)
Например, Mr (H2O) = 2×Ar (H) + Ar (O) = 2×1 + 16 = 18. Это значит, что одна молекула воды в 18 раз тяжелее атомной единицы массы.
Относительная молекулярная масса – одна из основных характеристик вещества.
14. Количество вещества (n) – это число формульных единиц или структурных частиц (молекул, атомов, ионов или других частиц), образующих данное вещество. Для измерения количества вещества в химии принята особая единица – моль.
Моль – это количество вещества определённой химической формулы, содержащее столько же формульных единиц (ФЕ), сколько атомов содержится в 12 г атомов изотопа углерода 12С. Указанная масса углерода содержит 6,02×1023 атомов. Это число называется постоянной Авогадро (NA). NA – это число структурных частиц, содержащихся в одном моле любого вещества:
NA = 6,02×1023 моль-1
Это означает, что 1 моль железа, 1 моль меди, 1 моль серы, 1 моль углерода и т.д. содержит одно и тоже число атомов. Это также означает, что 1 моль воды, 1 моль углекислого газа, 1 моль молекулярного водорода и т.д. содержит одно и то же число молекул. И в том и в другом случае число частиц (атомов, молекул), содержащихся в одном моле, равно числу атомов в одном моле углерода.
Число Авогадро огромно. Например, если собрать 6,02×1023 шаров, радиус которых 14 см, то их суммарный объём составит примерно такой же объём, какой занимает вся наша планета Земля. Другой пример: если взять такое количество самых маленьких песчинок кварцевого песка, то ими можно засыпать все океаны и моря земного шара.
15. Молярная масса (M) – это масса одного моля (6,02×1023 молекул) данного вещества, т. е. отношение массы вещества к количеству вещества:
m
M = ¾ , г/моль,
n
где m - масса вещества в граммах, n - количество вещества в молях. Значение
молярной массы численно совпадает с относительной атомной массой элемента или относительной молекулярной массой вещества. Например, молярная масса воды численно равна её относительной молекулярной массе. Мr (H2O) = 18; M (H2O) = 18 г/моль. Это значит, что один моль воды, т. е. 6,02×1023 её молекул, весит 18 г.
Исходя из молярной массы и числа Авогадро можно рассчитать абсолютные массы атомов и молекул по следующей формуле
M
mA (mM) = ¾
NA
Например, абсолютная масса молекулы серной кислоты равна
M (H2SO4) 98 г/моль
mM (H2SO4) = ¾¾¾¾¾ = ¾¾¾¾¾¾¾ = 1,63×10-22 г.
NA 6,02×1023 моль-1
Основные законы химии
1. Закон сохранения массы веществ. М.В. Ломоносов сначала теоретически, а затем опытным путём открыл и обосновал закон сохранения массы веществ (1748 г.), который лежит в основе всех химических реакций. Современная формулировка этого закона: при любом химическом процессе масса веществ, вступивших в химическую реакцию, равна массе веществ, образующихся в результате реакции.
Равенство масс исходных веществ и продуктов реакции объясняется тем, что при химической реакции происходит только перегруппировка атомов, а число атомов и масса каждого атома остаются постоянными. При записи химического уравнения это условие соблюдается путём подбора соответствующих коэффициентов.
2. Закон постоянства состава. Этот закон был сформулировал французским учёным Ж.. Прустом (1808 г.): любое химически чистое вещество независимо от способа его получения имеет постоянный качественный и количественный состав.
Закон постоянства состава вытекает из атомно-молекулярного учения: любое вещество состоит из молекул, а молекулы – из одного и того же количества атомов. Но поскольку атомы имеют постоянную массу, то и масса вещества в целом постоянна.
3. Закон эквивалентов.Этот закон был сформулирован немецким химиком В. Рихтером (1793 г.):химические элементы (вещества) взаимодействуют друг с другом в строго определённых количествах, прямо пропорциональных их эквивалентным массам (молярным массам эквивалентов).
В математической форме закон эквивалентов можно выразить следующим образом:
m (1) MЭК (1)m (1) m (2)
¾¾¾ = ¾¾¾ или ¾¾¾ = ¾¾¾ ,
m (2) MЭК(2) MЭК (1) MЭК (2)
где m (1) и m (2) – массы взаимодействующих веществ, МЭК(1) и МЭК(2) – эквивалентные массы, или молярные массы эквивалентов этих веществ.
Если одно из веществ, или оба, находится в газообразном состоянии, то закон эквивалентов может быть выражен следующими зависимостями
m (1) V (2) V(1) V(2)
¾¾¾ = ¾¾¾ или ¾¾¾ = ¾¾¾
MЭК (1) VЭК (2) VЭК (1) VЭК (2)
где V(1) и V(2) – объёмы газов, л, VЭК (1) и VЭК (2) – объёмы эквивалентов газов при н.у., л.
Понятие эквивалента было введено в химию для сопоставления соединительной способности различных элементов. Эквивалент – это условная частица, содержащаяся в одной формульной единице (ФЕ) вещества. В 1 ФЕ может находиться только целое число (1, 2, 3 и т.д.) эквивалентов вещества, которое называют эквивалентным числом или числом эквивалентности (Z). В связи с этим количество вещества эквивалентов в Zраз больше (или равно) количеству вещества:
nЭК = Z×n
Эквивалент элемента – это количество вещества в молях, которое соединяется с одним молем атомов водорода или замещает то же количество атомов водорода в химических реакциях.Например, необходимо определить эквивалент двухвалентного металла в следующей окислительно-восстановительной реакции:
II II
Me + 2HCl = MeCl2 + H2
Из уравнения реакции следует, что
1 моль атомов металла замещает ¾¾¾¾¾¾ 2 моль атомов водорода
х моль ¾¾¾ ² ¾¾¾ ¾¾¾¾¾¾ 1 моль ¾¾ ² ¾¾
Решая это простое соотношение, находим, что эквивалент двухвалентного металла равен ½ моль.
Эквивалент элемента можно найти и через понятие «эквивалентное число» по формуле:
Эк (Х) = 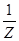
В окислительно-восстановительной реакции эквивалентное число Z восстановителя (Me) определяется числом электронов, отданных 1 ФЕ восстановителя. В приведённой выше реакции Z(Me) = 2, тогда:
Эк (Ме) = 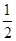 моль
моль
Для обменной реакции:
mA + nB = pC + qD
эквивалентное число, например, вещества А рассчитывают как отношение стехиометрических коэффициентов реакции:
Z(А) = 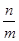
Для выполнения различных количественных расчётов в химии введено ещё одно понятие – эквивалентная масса (молярная масса эквивалента).
Эквивалентная масса (молярная масса эквивалента)– это масса одного эквивалента вещества, выраженная в граммах на моль, т. е. отношение массы вещества к его количеству вещества эквивалентов:
МЭК = 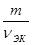
Различают молярные массы эквивалента элемента, оксида, кислоты, основания и соли.
1. Молярная масса эквивалента элемента – это отношение молярной массы атомов элемента к его валентности (В) в данном химическом соединении
M
МЭК = ¾¾ , г/моль
B
По этой формуле определяется теоретическое значение молярной массы эквивалента элемента. Например, молярная масса эквивалента углерода в оксиде углерода (II) CO , будет равна
МЭК (С) = ¾ = 6 г/моль,
а в оксиде углерода (IV) CO2
МЭК (С) = ¾ = 3 г/моль.
В отличие от молярной массы, молярная масса эквивалента элемента не является постоянной величиной. Постоянное значение молярной массы эквивалента может быть только у элементов с постоянной валентностью.
2. Молярная масса эквивалента оксида – это частное от деления его молярной массы на произведение из числа атомов элемента и его валентности. Например
МЭК (Al2O3) = ¾¾ = 21,5 г/моль.
3. Молярная масса эквивалента кислоты – это частное от деления её молярной массы на основность кислоты, т. е. на число атомов водорода в её молекуле, участвующих в реакции. Например. Серная кислота H2SO4 – двухосновная кислота , так как в состав её молекулы входят 2 атома водорода. В химических реакциях могут участвовать от молекулы кислоты один или два атома водорода. В первом случае эквивалентная масса серной кислоты будет равна молярной массе – 98 г/моль, во втором случае её половине – 49 г/моль.
4. Молярная масса эквивалента основания - это частное от деления её молярной массы на кислотность основания, т. е. на число групп OH в его молекуле, участвующих в реакции. Например. Если в реакции между гидроксидом алюминия и соляной кислотой участвуют 2 группы ОН основания Al(OH)3, то его эквивалентная масса будет равна:
МЭK (Al(OH)3) = ¾¾ = 39 г/моль.
5. Молярная масса эквивалента соли - это частное от деления её молярной массы на произведение из числа атомов металла и его валентности. Например. Эквивалентная масса сульфата алюминия равна
МЭК (Al2(SO4)3) = ¾¾ = 57 г/моль.
2×3
4. Закон кратных отношений. Этот закон был открыт английским химиком Дж. Дальтоном (1808 г.): если два элемента образуют между собой несколько соединений, то весовые количества одного элемента, соединяющиеся с одним и тем же весовым количеством другого элемента, относятся между собой как небольшие целые числа. Закон этот хорошо иллюстрируется на примере оксидов азота, которых известно пять. На 1 вес.ч. азота приходится следующее количество вес.ч. кислорода:
N2O, NO, N2O3, NO2, N2O5
0,57 1,14 1,71 2,28 2,85
Приняв 0,57 вес.ч за единицу, получим следующее относительное весовое содержание кислорода:
1 2 3 4 5
Тот факт, что элементы входят в соединения некоторыми определёнными порциями, свидетельствует о прерывном строении вещества. Тем самым Дальтон экспериментально доказал, что все вещества состоят из мельчайших частиц - атомов.
5. Закон объемных отношений. Этот закон был открыт французским химиком Ж. Гей-Люссаком (1805 г.): объёмы вступающих в реакцию газов при одинаковых температуре и давлении относятся друг к другу, а также к объёмам образующихся газообразных продуктов как небольшие целые числа.
Например, для реакции:
N2(г) + 3Н2(г) = 2NH3(г)
объёмы реагирующих и образующихся газов относятся друг к другу как 1:3:2.
6. Закон Авогадро. Для объяснения закона простых объёмных отношений в реакциях газообразных веществ итальянский учёный Авогадро выдвинул гипотезу, которая впоследствии была подтверждена экспериментально и получила статус закона (1811 г.): в равных объёмах различных газов при одинаковых физических условиях (температуре и давлении) содержится одинаковое число молекул.
Из закона Авогадро вытекают два следствия:
а) Одинаковое число молекул различных газов при одинаковых условиях занимают одинаковый объём.
б) Один моль любого газа при одинаковых условиях занимает один и тот же объём.
Объём, занимаемый 1 моль газа можно вычислить, если известна абсолютная плотность газа (Да). Да – это масса 1 л газа при нормальных условиях (н.у.). Нормальные условия: температура 0 0С (273 0К) и давление 1 атм (760 мм рт.ст.) или 101,3 кПа.
Например, абсолютная плотность водорода Да (H2) = 0,09 г/л. Молярная масса водорода М (H2) = 2,016 г/моль. Найдём объём, занимаемый 1 моль водорода из соотношения
0,09 г (Да) водорода занимает при н.у. ¾¾¾¾¾ 1 л
2,016 (М) ¾¾¾ ² ¾¾¾ ¾¾¾¾¾ х л
 | |||
 | |||
M
х = 22,4 л/моль 22,4 = ¾
Да
Молярным объёмом газа (Vм) – это объём одного моля любого вещества в газо- или парообразном состоянии при нормальных условиях, т. е. отношение объёма газа к количеству вещества этого газа
V
Vм = ¾ ,
n
где V- объём газа в литрах, n - количество вещества в молях. Поскольку 1 моль любого вещества содержит 6,02×1023 структурных частиц, то такое количество молекул газа при н.у. занимают объём, равный 22,4 л. Из приведённого выше примера следует, что молярные массы газообразных веществ можно определить на основе закона Авогадро по следующей формуле
M = Да× 22,4
7. Относительная плотность одного газа по другому. Для определения молекулярной массы газообразного вещества удобнее пользоваться понятием не абсолютной, а относительной плотности. Относительная плотность одного газа по другому (Д2(1)) – это отношение масс этих двух газов, взятых в равных объёмах при одинаковых условиях
m (1)
Д2(1) = ¾¾
m (2)
Относительная плотность – величина безразмерная.
Из закона Авогадро следует:
Д2(1) = 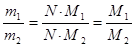 ,
,
что относительная плотность одного газа по другому равна отношению их молярных (М) или относительных молекулярных масс (Мr)
M (1) Mr (1)
Д2 (1) = ¾¾¾ или Д2(1) = ¾¾
M (2) Mr (2)
Обычно плотность газа определяют по отношению к водороду (ДН2) или воздуху (Двозд.).
Относительная плотность любого газа (Х) по водороду:
Мr (X) Mr (X)
ДН2 (Х) = ¾¾¾ = ¾¾¾
Mr (H2) 2
Из приведённого выше уравнения следует: молекулярная масса исследуемого газа Х равна его удвоенной плотности по водороду:
Мr (X) = 2× ДН2 (Х)
Относительная плотность газа (Х) по воздуху
Mr (X) Mr (X)
Двозд. (Х) = ¾¾¾¾ = ¾¾¾ .
Mr (возд.) 29
Средняя молекулярная масса воздуха вычисляется исходя из того, что воздух в основном состоит из 78 об. % азота, 21 об. % кислорода 1 об. % других газов
78×28 + 21×32
Мr (возд.) = ¾¾¾¾¾¾¾ = 28,56 » 29.
Молекулярная масса исследуемого газа по его плотности по воздуху определяется выражением:
Мr (X) = 29× Двозд. (Х)
8. Объединённое уравнение газового состояния. Для приведения объёма газа к нормальным условиям пользуются объединённым уравнением идеального состояния газа (объединяет законы Бойля-Мариотта и Гей-Люссака):
P V Po Vo
¾¾ = ¾¾¾
T To
Отсюда:
P V To
Vo = ¾¾¾¾
Po T
Переход от международной стоградусной шкалы 0С к абсолютной шкале 0К производится по формуле:
Т = 273 + t,
где Т – температура в 0К; t – температура в 0С.
|
из
5.00
|
Обсуждение в статье: Например, абсолютная масса молекулы серной кислоты равна |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

