 |
Главная |
Внутренняя энергия идеального газа
|
из
5.00
|
Формулировка I начала термодинамики
А)В любой изолированной системе запас энергии остаётся постоянным. Это — формулировка Дж. П. Джоуля (1842 г.).
Б)Количество теплоты, полученное системой, идёт на изменение её внутренней энергии и совершение работы против внешних сил.
В) термодинамическая система может совершать работу только за счёт своей внутренней энергии или каких-либо внешних источников энергии. Первое начало термодинамики часто формулируют как невозможность существования вечного двигателя первого рода, который совершал бы работу, не черпая энергию из какого-либо источника.
Внутренняя энергия идеального газа
В теории идеального газа потенциальная энергия взаимодействия молекул считается равной нулю. Поэтому внутренняя энергия идеального газа определяется кинетической энергией движения всех его молекул. Средняя энергия движения одной молекулы равна
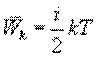
9) Кол-во теплоты
Q- энергия, которую тело теряет или приобретает при передаче тепла.
Формула количества теплоты зависит от протекающего процесса.
Формулы количества теплоты при некоторых процессах:
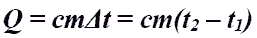 Количество теплоты при нагревании и охлаждении.
Количество теплоты при нагревании и охлаждении.
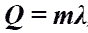 Количество теплоты при плавлении или кристаллизации.
Количество теплоты при плавлении или кристаллизации.
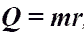 Количество теплоты при кипении, испарении жидкости и конденсации пара.
Количество теплоты при кипении, испарении жидкости и конденсации пара.
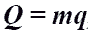 Количество теплоты при сгорании топлива.
Количество теплоты при сгорании топлива.
Количество теплоты всегда передается от более горячихтел к более холодным до достижения ими одинаковой температуры (теплового равновесия), если нет иных процессов, кроме теплопередачи.
В замкнутой системе тел выполняется уравнение теплового балланса: Q1 + Q2 + ... = 0 - количество теплоты, которое теряют горячие тела, равно количеству тепла, получаемому холодными.
При Изохорный процесс (V=const). 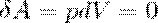 =>
=> 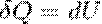
Изобарный процесс (p=const).  (2)
(2)
Если использовать уравнение Менделеева-Клапейрона для выбранных нами двух состояний, то
 и
и 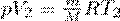
откуда 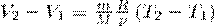
Тогда выражение (2) для работы изобарного расширения примет вид
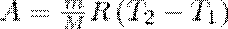 (3)
(3)
Из этого выражения вытекает физический смысл молярной газовой постоянной R: если T2 —T1 = 1К, то для 1 моль газа R=A, т. е. R численно равна работе изобарного расширения 1 моль идеального газа при нагревании его на 1 К.
В изобарном процессе при сообщении газу массой m количества теплоты
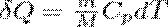
его внутренняя энергия возрастает на величину (т.к. CV=dUm/dt)
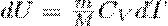
При этом газ совершит работу, определяемую выражением (3).
Изотермический процесс (T=const). Изотермический процесс описывается законом Бойля—Мариотта:
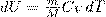
Диаграмма этого процесса (изотерма) в координатах р, V представляет собой гиперболу, которая расположена на диаграмме тем выше, чем выше температура, при которой происходит процесс.
Исходя из формул для работы газа и уравнения Менделеева-Клайперона найдем работу изотермического расширения газа:
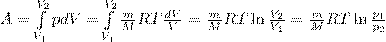
Так как при Т=const внутренняя энергия идеального газа не изменяется:
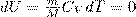
то из первого начала термодинамики (δQ=dU+δA) следует, что для изотермического процесса

т. е. все количество теплоты, сообщаемое газу, расходуется на совершение им работы против внешних сил:
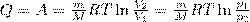 (4)
(4)
Значит, для того чтобы при расширении газа температура не становилась меньше, к газу в течение изотермического процесса необходимо подводить количество теплоты, равное внешней работе расширения.0
10)Уде́льная теплоёмкость (Удельная теплота нагревания на один градус, обозначается как c) вещества определяется как количество тепловой энергии, необходимой для повышения температуры одного килограмма вещества на один градус.
Формула расчёта удельной теплоёмкости: 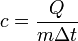 , где
, где  — удельная теплоёмкость,
— удельная теплоёмкость, 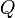 — количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении),
— количество теплоты, полученное веществом при нагреве (или выделившееся при охлаждении), 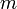 — масса нагреваемого (охлаждающегося) вещества,
— масса нагреваемого (охлаждающегося) вещества, 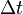 — разность конечной и начальной температур вещества.
— разность конечной и начальной температур вещества.
Молярная теплоёмкость (Сμ) — это количество теплоты, которую необходимо подвести к 1 молю вещества, чтобы нагреть его на 1 K, измеряется в джоулях на моль на кельвин (Дж/(моль·К)).
V=const => dA=o =>dQ=dU dU = i/2 *vRdT Сμv=i/2*R
P=const => dU=i/2 vRdT +vRdT Сμp=i/2*R+R
Сμp= Сμv+R
Связь удельной с молярной Сμ=μ*c
11)Адиабатный процесс, происходящий в физической системе без теплообмена с окружающей средой.
Уравнение Адиабатный процессQ=0, A=dU dU=i/2( 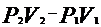 )
)
***
|
из
5.00
|
Обсуждение в статье: Внутренняя энергия идеального газа |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

