 |
Главная |
Общая характеристика галогенов
|
из
5.00
|
Галогены – (дословно «рождающие соли») элементы главной подгруппы VII группы Периодической системы, типичные неметаллы.
К ним относятся фтор (F), хлор (Cl), бром (Br), йод (I), астат (At).
На внешнем уровне галогенов 7 электронов, поэтому они являются активными окислителями (принимают электроны). В группе окислительные свойства уменьшаются сверху вниз, а неметаллические свойства ослабевают.
Степени окисления галогенов: +1, +3, +5, +7, -1. У фтора степень окисления только «-1».
В природе галогены находятся в связанном состоянии( в составе соединений) из-за своей высокой химической активности. Наиболее распространены в природе фтор и хлор.
В группе каждый вышестоящий галоген вытесняет менее активный из его солей.
Все галогены являются двухатомными молекулами, поэтому имеют индекс 2: Cl2, Br2, I2, F2. Связаны ковалентной неполярной связью.
В твёрдом состоянии Cl2, Br2, I2, F2 имеют молекулярныекристаллические решётки.
Физические свойства:
1. Агрегатное состояние

2. Все галогены – ТОКСИЧНЫЕ вещества!!! С резким раздражающим запахом.
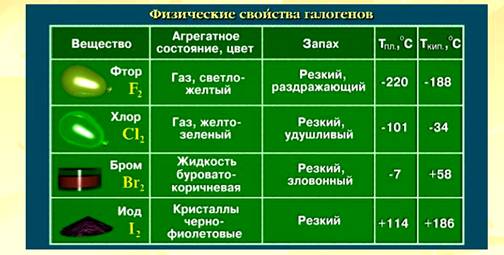
3. Имеют высокую реакционную способность (легко вступают в реакции) и электроотрицательность.
Химические свойства:
1. Обладают большой летучестью.
2. Малорастворимы в воде.
3. Взаимодействуют с Н2.

Свободный хлор Cl2
Хлор – очень сильный окислитель. Окисляет металлы, неметаллы и сложные вещества, превращаясь при этом в очень устойчивые анионы Cl-.
Физические свойства: Cl2 – газ желто-зеленого цвета с резким удушающим запахом, тяжелее воздуха.
Хлор слабо растворяется в воде. При комнатной температуре в 1 объёме воды растворяется 2,5 объёма хлора. Образовавшийся раствор называется хлорной водой.
Химические свойства
В химических реакциях хлор является окислителем.
1. Реакции с металлами
Активные металлы в атмосфере сухого газообразного хлора воспламеняются и сгорают; при этом образуются хлоридыметаллов.
Cl2 + 2Na = 2NaCl – хлорид натрия
3Cl2 + 2Fe = 2FeCl3 – хлорид железа (III)
Малоактивные металлы легче окисляются влажным хлором или его водяными растворами:
Cl2 + Cu = CuCl2
3Cl2 + 2Au = 2AuCl3
2. Реакции с неметаллами
Хлор НЕ взаимодействует только с О2, N2, C. С остальными неметаллами реакции протекают при различных условиях. Образуются галогениды неметаллов.
Наиболее важной является реакция взаимодействия с водородом.
Cl2 + H2  2HCl
2HCl
Cl2 + 2S(расплав)  S2Cl2
S2Cl2
3Cl2 + 2P = 2PCl3 (или PCl5 – в избытке Cl2)
3. Вытеснение свободных неметаллов из их соединений:
Cl2 + 2KBr = Br2 + 2KCl
Cl2 + 2KI = I2 + 2KCl
В результате самоокисления-самовосстановления одни атомы хлора превращаются в анионы Cl-, а другие в положительной степени окисления входят в состав анионов ClO- или ClO3–.
Cl2 + H2O = HCl + HClO (хлорная вода)
Cl2 + 2KOH = KCl + KClO + H2O (жавелевая вода)
Cl2 + 6KOH = 5KCl + KClO3 + 3H2O
3Cl2 + 2Ca(OH)2 = CaCl2 + Ca(ClO)2 + 2H2O (хлорная известь)
Эти реакции имеют важное значение, поскольку приводят к получению кислородных соединений хлора: KClO и Ca(ClO)2 – гипохлориты; KClO3 – хлорат калия (бертолетова соль).
Промышленный способ получения хлора — электролиз расплава или раствора хлорида натрия:
2NaCl=2Na+Cl2↑,
2NaCl+2H2O=2NaOH+Cl2↑+H2↑.
В лаборатории его получают реакцией соляной кислоты с оксидом марганца(IV):
4HCl+MnO2=MnCl2+Cl2↑+2H2O.
Соединения хлора:
Хлороводород
Хлороводород образуется при взаимодействии хлора с водородом:
H2+Cl2=t 2HCl.
Или при действии концентрированной серной кислоты на твёрдые хлориды:
H2SO4(к)+2NaCl=t2HCl↑ +Na2SO4.
Химическая связь в молекуле хлороводорода — ковалентная полярная. Он представляет собой бесцветный газ с резким запахом, тяжелее воздуха. Хлороводород очень хорошо растворяется в воде: в 1 объёме воды растворяется до 500 объёмов хлороводорода.
Соляная кислота
Раствор хлороводорода в воде называется соляной, или хлороводородной кислотой. Это бесцветная жидкость с запахом. Соляная кислота относится к сильным одноосновным кислотам с характерными для этих веществ свойствами.
Соляная кислота:
- изменяет окраску индикаторов;
- взаимодействует с металлами, расположенными в ряду активности до водорода:
Fe+2HCl=H2+FeCl2;
- взаимодействует с основными и амфотерными оксидами:
ZnO+2HCl=H2O+ZnCl2;
- взаимодействует с основаниями и амфотерными гидроксидами:
KOH+HCl=H2O+KCl;
- взаимодействует с солями, если продуктом реакции являются газ, осадок или слабый электролит (с карбонатами, силикатами, сульфидами, растворимыми солями серебра и т. д.):
CaCO3+2HCl=CaCl2+H2O+CO2↑,
Na2S+2HCl=2NaCl+H2S↑,
AgNO3+HCl=HNO3+AgCl↓.
Большинство солей соляной кислоты хорошо растворяется в воде. К нерастворимым относится хлорид серебра!!! Он выпадает в виде белого творожистого осадка!!! при взаимодействии раствора нитрата серебра с соляной кислотой или с растворами хлоридов. Эту реакцию используют как качественную реакцию на ионы хлора. Краткое ионное уравнение:
Ag+ + Cl - =AgCl↓. (реакция в ионном виде, в молекулярном будет такой: 2Ag + Cl2 = 2AgCl↓).


|
из
5.00
|
Обсуждение в статье: Общая характеристика галогенов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

