 |
Главная |
Характеристика световой и темновой репарации, SOS – репарации, прямой репарации.
|
из
5.00
|
Министерство образования Республики Беларусь
Учреждение образования
«Международный государственный экологический университет имени А. Д. Сахарова»
Белорусского государственного университета
Факультет экологической медицины
Кафедра экологической медицины и радиобиологии
Контрольная работа
По дисциплине: «Молекулярная и клеточная радиобиология с основами радиационной гигиены»
Студентки 4 курса ФЭМ Группы 43072
Тимоховой Елизаветы Сергеевны
Номер зачетной книжки: 43073-14
Преподаватель:
Старший преподаватель кафедры экологической медицины и радиобиологии
________И. В. Пухтеева
Минск 2018
Характеристика световой и темновой репарации, SOS – репарации, прямой репарации.
Репарация (от лат.Reparatio – восстановление) – особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывыв молекулах ДНК, повреждённых при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических реагентов. Осуществляется специальными ферментными системами клетки. Ряд наследственных болезней (напр., пигментная ксеродерма) связан с нарушениями систем репарации.
Самый простой и эффективный путь восстановления поврежденных нуклеотидов в составе ДНК – это прямое обращение тех химических реакций, индуцированных химическими или физическими агентами, результатом которых стало данное повреждение. Такой способ устранения повреждений принято называть прямой репарацией. К сожалению, с помощью реакций этого типа может быть исправлено только ограниченное число повреждений. Реакциями прямой репарации являются фотореактивация, репарация с помощью метилтрансфераз (репарация алкилированного гуанина), прямая вставка пуринов инсертазой и прямое зашивание однонитевых разрывов полинуклеотидлигазой.
Репарация О6-Алкилированного Гуанина.
В 1944–1948 годах выдающийся советский генетик И.А. Рапопорт нашел новый класс химических мутагенов, способных добавлять к взаимодействующим с ними молекулам алкильные (метиловые, этиловые, пропиловые, бутиловые) боковые группы, и назвал их алкилирующими агентами. В конце 60-х годов стало ясно, что обработка клеток алкилирующими агентами вызывает, в зависимости от агента N– или О-алкилированние пуринов и пиримидинов, а также трифосфатов. Один из наиболее мощных алкилирующих мутагенов, метил-нитро-нитрозогуанидин, может алкилировать гуанин, присоединяя метальную группу к кислороду, связанному с шестым атомом кольца. Полученный продукт был назван О6-метил-гуанином. В 1978–1979 годах генетики и биохимики обнаружили, что метильная группа может отщепляться от гуанина и тогда происходит прямое восстановление структуры ДНК в этой точке. В 1982–1988 годах было установлено, что такой же механизм функционирует при репарации О4-алкилтимина.
Последующие исследования показали, что в клетках млекопитающих есть целый класс белков метилтрансфераз, которые могут захватывать метальные группы от модифицированного гуанина, переносить их с поврежденного основания на цистеин метилтрансферазы и благодаря этому восстанавливать исходную структуру ДНК. При этом сами метилтрансферазы инактивируются. Например, фермент, кодируемый геном ada (Об-метил-гуанин-трансфераза), распознает Об-метилгуанин в ДНК и удаляет метильную группу, возвращая основание в исходную форму.Репарацией О4-алкилтимина ведает О4-метил-тимин-ДНК-метилтрансфераза. Важно понять, что метилтрансфераза, захватив метильную группу, не может от нее освободиться. Тем самым в прямом смысле метилтрансферазы не являются ферментами, так как настоящие ферменты по определению не изменяются в ходе реакций. Если для каждого акта прямой репарации О6-метилгуанина или О4-алкилтимина нужна новая молекула белка, клетка вынуждена запускать синтез новых его порций. Обычно для обеспечения репарации внутри клетки их накапливается несколько тысяч, по одной молекуле уходит на каждое повреждение. Если процесс возникновения новых повреждений в ДНК идет медленнее, чем синтез новых порций метилтрансфераз, то последних хватает на захват всех метильных групп в гуанинах, и мутации не возникают. Если же скорость внесения новых повреждений превышает скорость синтеза метилтрансфераз, последние перестают справляться со всеми повреждениями, и в клетках накапливаются метилированные основания и предшественники.
В минуту в клетке Е. coli может синтезироваться порядка 100 молекул метилтрансфераз. Следовательно, мутации не возникнут, если скорость возникновения повреждений будет меньше 100 в минуту.
Необходимо отметить, что О6-алкилгуанины являются одними из самых значимых повреждений, несмотря на то, что их общее количество среди всех повреждений ДНК, вызванных алкилированием меньше 8 %. В основном это О6-метилгуанин и О6-этилгуанин, основания, способные к неправильному спариванию и являющиеся основной причиной возникновения транзиций GC-AT. К тому же именно эти повреждения не удаляются другими системами репарации, например, эксцизионной репарацией оснований (baseexcisionrepair, BER), а при действии другой эксцизионной системы репарации – репарации неспаренных оснований(missmathrepair, MMR), приводят к возникновению двунитевых разрывов. Другим столь же серьезным предмутационнымалкилированным основанием является появляющийся крайне редко О4-метилтимин, – всего менее 0.4 % среди всех вызванных алкилированием повреждений. То есть в случае двух данных повреждений при инактивации или подавлении их прямого восстановления с участием метилтрансфераз, другие системы репарации окажутся бесссильны.
В человеческих клетках О6-алкилированные повреждения могут быть восстановлены в прямой реакции О6-метилгуанин-ДНК–метилтрансферазой (MGMT, ATase, AGT,AGAT), которая является гомологом продукта гена ada (ADA) E.coli.
С-концевой домен (остатки 86-207) содержит консервативный активный сайт с цистеиновым мотивом (IPCHRV), канал для связывания 06-алкилгуанина и ДНК-распознающий мотив спираль-поворот-спираль (Н6), работающий благодаря его внедрению в глубокую бороздку ДНК.
Гуанин «втаскивается» внутрь активного канала вдоль распознающей спирали. Гуанин-специфические водородные связи устанавливаются между белком и ДНК.
Человеческий MGMT ген картирован на 10q26 и кодирует белок с молекулярным весом в 24 кД, состоящий из 207 аминокислотных остатков. Этот белок переносит метил или хлорэтил из поврежденного гуанина на остаток цистенина в своем активном центре. Активность MGMT была измерена в различных тканях человека, как нормальных, так и опухолевых и было показано, что его экспрессия, особенно в опухолевых тканях, может быть различной. Клетки, дефектные по этому гену, не способны к репарации О6-алкилгуанина, в них резко повышен уровень мутаций, вызываемых алкилирующими агентами, сестринских хроматидных обменов и хромосомных аберраций. Мыши, нокаутные по MGMT жизнеспособны, но у них резко повышено количество спонтанно возникающих опухолей и они чувствительны к действию алкилирующих агентов. Напротив, у мышей с оверэкспрессией MGMT спонтанные опухоли развиваются значительно реже, чем у контрольных. MGMT был первым геном млекопитающих, у которого была показана экспрессия, индуцированная действием генотоксического стресса и глюкокортикоидов, приводящая к адаптивному ответу клетки на мутагенное и токсическое действие простых алкилирующих агентов.
Экспрессия MGMT регулируется метилированием как самого гена, так и его промотора, причем метилирование промотора приводит к ее ингибированию, а метилирование самого гена к повышению экспрессии MGMT. С метилированием MGMT также связана повышенная устойчивость клеток меланомы к действию хлорэтиловых антиопухолевых препаратов.
Репарация Однонитевых Разрывов ДНК.
Еще один тип реакций прямой репарации был обнаружен для однонитевых разрывов ДНК, индуцируемых, например, ионизирующим излучением. При этом с помощью фермента ДНК полинуклеотидлигазы (от англ. ligase – соединять, связывать) происходит прямое воссоединение разорванных концов в молекуле ДНК. Здесь у нас есть возможность немного подробнее остановиться на роли лигаз в клетке. ДНК лигазы являются важными ферментами метаболизма ДНК. Они катализируют реакцию объединения концов ДНК, необходимую для репликации ДНК и для тех путей репарации, при которых есть репаративный синтез. У большинства организмов лигазы используют энергию АТФ, и лишь у эубактерий – энергию НАД(+). Интересно, что несмотря на различия в аминокислотных последовательностях и биохимических реакциях между этими двумя классами лигаз, структура аденилирующего домена у них совершенно одинакова.
Полинуклеотидлигаза является основным ферментом у E.coli, а высшие организмы производят несколько различных лигаз, имеющих специфические мишени и функции. Лигаза I необходима для сшивания фрагментов Оказаки и некоторых репарационных реакций, лигаза II не является отдельным самостоятельным ферментом, а появляется как продукт деградации лигазы III, ДНК лигаза III имеет несколько изоформ, вовлеченных в процессы репарации и рекомбинации, а ДНК лигаза IV необходима для V(D)J рекомбинации и негомологичного соединения концов ДНК при воссоединении двунитевых разрывов. Изучение аминокислотной последовательности и структурный анализ показали, что все лигазы построены вокруг общего каталитического кора, подобного таковому у лигазы бактериофага Т-7, структура которого до сих пор недостаточно ясна.
Репарация АР-Сайтов за счет прямой вставки пуринов.
Голландский ученый Т. Линдал в 1979 году нашел, что при некоторых типах повреждений пуриновых оснований ковалентная связь между основанием и сахаром (гликозидная связь) может рваться. Тогда в молекуле ДНК на месте этих оснований образуется брешь, названная АР-сайтом. Термин приложим также к случаям, когда из ДНК выпадают пиримидиновые основания (термин АР-сайт, таким образом, объединяет все случаи выщепления оснований с образованием и апуриновых и апиримидиновых сайтов). Описаны ферменты, названные инсертазами (insert – вставлять), которые могут вставлять в брешь такое же основание, какое было до повреждения, и соединять его с сахаром. Например, ДНК-пурин-инсертаза, которая катализирует образование N-гликозидной связи между 1-атомом дезоксирибозыапурин/апиримидинового сайта (АР-сайта), образовавшегося напротив пиримидина, и комплементарным ему основанием. Структура ДНК приобретает исходный неповрежденный вид. Однако только ограниченное число АР-сайтов может быть исправлено с помощью этого типа реакции.
В зависимости от того, участвует ли видимый свет в модификации повреждений ДНК, репарацию можно подразделить на световую и темновую. Конкретно под световой репарацией понимается феномен фотореактивации, впервые описанный у актиномицетов.
Фотореактивация открыта в 1948 И. Ф. Ковалевым (СССР), А. Келнером и Р. Дульбекко (США) в опытах синфузориями, парамециями, коловратками, конидиями грибов, бактериями и бактериофагами.
Было продемонстрировано повышение выживаемости облученных летальными дозами УФ-света организмов после воздействия видимым светом.
В дальнейшем фотореактивация была обнаружена в клетках некоторых рыб, птиц, амфибии, насекомых, высших растений и водорослей. В 1969 году было доказано, что способностью к фотореактивации обладают сумчатые животные. Исследования последних лет указывают на наличие фотореактивирующего фермента и в клетках кожи человека. Сегодня считается, что фотолиаза имеется у всех организмов, за исключением бактерий Micrococcusradiodurans.
Фотореактивация - уменьшение повреждающего действия ультрафиолетового излучения на живые клетки при последующем воздействии на них ярким видимым светом (рис.1).Механизм фотореактивации действует только на пиримидиновыедимеры. В этом процессе участвует фермент фотореактивациидезоксирибопиримидинфотолиаза, который связывается с димерами. Образующийся фермент-субстратный комплекс активируется видимым светом, что приводит к мономеризациидимеров. Эффективность фотореактивации зависит от уровня рН, температуры и физиологического состояния клетки.Таким образом, летальный эффект УФ-облучениясущественно снижается, если облученные клетки подвергаются затем воздействию видимого света с длинами волн от 360 до 420 нм.

Рисунок 1. Фотореактивация
Одним из основных путей устранения клеткой опасных для жизни повреждений генома является выработанный в ходе эволюции ферментативный аппарат темновой репарации (рис.2). Основной принцип работы этого аппарата заключается в удалении (эксцизии) фотохимически поврежденных участков полинуклеотидной цепи с последующей застройкой дефекта нормальными молекулярными компонентами (нуклеотидами). Результат деятельности системы темновой репарации — прогрессирующее во времени уменьшение содержания димеров в ДНКклетки после УФ-облучения, сопровождающееся стехиометрическим ростом концентрации свободных, не включенных в состав ДНК димеров в цитоплазме. При этом вырезанные пиримидиновые димеры обнаруживаются в кислоторастворимой фракции цитоплазмы. Вещества, ингибирующие работу ферментов темновой репарации, — кофеин, акридиновые красители, липиды — резко повышают фоточувствительность клеток.
Впервые на существование в клетке темновой репарации указали в 1964 г. Сетлоу и Кэрие, Бойс и Ховард-Фландерс.
К настоящему времени выявлено, по крайней мере, три основных типа темновой репарации — эксцизионная, пострепликативная и так называемая SOS-репарация. В эксцизионной репарации выделяют четыре основные стадии:
1) обнаружение, места повреждения и разрез одной из нитей ДНК;
2) вырезание поврежденного фрагмента полинуклеотидной цепи и расширение бреши;
3) комплементарная застройка дефекта по матрице оставшейся нити ДНК;
4) восстановление целостности полинуклеотидной цепи путем соединения концов. Разрез полинуклеотидной цепи около места повреждения осуществляется с помощью фермента кор-рендонуклеазы II — продукта генов uvr А и uvr В Е. coli. Вырезание поврежденного фрагмента с последующим расширением бреши и ее застройкой (репаративный синтез) происходит с помощью ДНК-полимеразы I с участием продуктов генов uvr С, uvr Е и mfd. Наконец,ферментполинуклеотидлигаза катализирует замыкание концов нити ДНК с восстановлением исходной структуры. Считается, что в процессе эксцизионной репарации могут принимать участие ДНК-полимераза II и ДНК-полимераза III. Некоторые ферменты темновой репарации выделены из микробных клеток и изучены invitro. Генетические методы позволили также получить различные мутанты, дефицитные по отдельным ферментам темновой репарации.
Необходимо подчеркнуть, что описанные стадии темновой репарации происходят перед репликацией ДНК (делением клеток) и независимо от нее. Поэтому этот механизм получил также название предрепликативной репарации.
Наряду с ним существует и другой механизм — пострепликативнаярепарация, требующая продуктов гена гес А. Основные особенности пострепликативной репарации сводятся к двум моментам:
1) восстановление дефектов происходит не до, а после репликации ДНК: нити, содержащие димеры или другие повреждения, вовлекаются в процесс репликации с возникновением разрывов у дочерней ДНК, расположенных против поврежденных участков материнской комплементарной матрицы;
2) застройка дефектов у дочерней ДНК происходит в ходе рекомбинационных процессов с использованием информации в неповрежденной нити ДНК. Обязательное условие успешной репарации — наличие против бреши интактного участка второй комплементарной нити ДНК.
Таким образом, в ходе пострепликативной репарациивообще не происходит вырезание димеров или других фотохимических повреждений.
Пострепликативный механизм репарации обеспечивает выживание клетки даже при наличии в ее геноме до 100 пиримидиновыхдимеров. На основе этого механизма легко объясняется факт сохранения димеров в ДНК у чувствительных к УФ-свету мутантов на протяжении нескольких циклов репликации. Как и предрепликативная, пострепликативная репарация определяется набором специфических ферментов.

К настоящему времени в экспериментах с Е. coli накоплено большое число фактов, которые невозможно объяснить с помощью двух рассмотренных выше механизмов темновой репарации. Например, каким образом происходит восстановление ДНК при повреждении противолежащих участков обеих ее нитей, когда вообще отсутствует матрица для застройки возникающих на их месте брешей. Этот и другие факты стимулировали выдвижение представлений о новом гипотетическом механизме — SOS-репарации (международный сигнал бедствия) или иидуцибельной репарации с ошибками.
Данный механизм начинает функционировать в тех случаях, когда клетке грозит гибель из-за неспособности обычных, эксцизиоииой и пострепликативной, систем устранить брешь, противолежащую фотопродукту в комплементарной цепи ДНК, и перекрывающиеся бреши в сестринских цепях. В этих условиях в клетке появляется особый тип ДНК-полимеразы — SOS-полимераза, которая способна в противоположность другим ферментам заполнять брешь в дочерней цепи, используя в качестве матрицы материнскую цепь, содержащую димеры. Против димера, как правило, возникают ошибки (мутации). Действительно, в опытах Рэдмана клеточные экстракты SOS-культуры tif1 Е. coli обладали способностью репарировать УФ-повреждения в синтетических поли-dT-dA-HyK-леотидах с ошибочной заменой димеровтимина на гуании и цитозин. Предполагается, что SOS-полимераза может быть продуктом дерепрессирования гена или модифицированной индуцибельным фактором ДНК-полимеразой III.
Следует отметить, что для проявления SOS-репарации (рис. 3) необходимы продукты генов гес А и lex А. В рамках SOS-гипотезы предполагается, что повреждения ДНК инициирует регуляторный сигнал, приводящий к активации различных функций, направленных на выживание клетки в экстремальных условиях.
С участием SOS-системы осуществляется и репарация межнитевых сшивок ДНК, относящихся к высоколетальным повреждениям
На первом этапе происходит выщепление плеча сшивки ферментами uvr-системы — системы эксцизии, на втором — защита однотяжевого участка от действия нуклеаз с помощью фермента рестрикции-модификации (RMft), который в обычных условиях обеспечивает клетке способность узнавать и разрушать чужеродную ДНК, на третьем — заполнение бреши в ходе синтеза denovo при помощи продуктов генов гес А и lex А. Если же в клетке представлен второй геном, неповрежденный в данном сайте, то заполнение бреши идет рекомбинационным путем, контролируемым продуктами гена гес А.
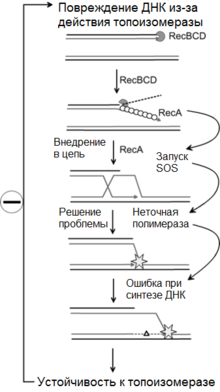
Рисунок 3. SOS-репарация
Активность и согласованность работы специфических ферментов темновой репарации определяет эффективность всей системы в целом, которая сильно варьирует у различных клеток. Например, у некоторых фоторезистентных штаммов Е. coliрепарируется 90—98% повреждений, а у клеток человека в культуре (HeLa) - только 40%. Известны также микроорганизмы, дефектные по ферментам системы темновой репарации и поэтому обладающие повышенной фоточувствительностью.
Одновременное повреждение, локусов ДНК, ответственных за синтез ферментов темновой репарации (uvr-) и рекомбинации (rec-) у двойных мутантов, приводит к столь резкому повышению фоточувствительности, что клетка гибнет при образовании лишь одного пиримидинового димера.
К настоящему времени получено и классифицировано большое количество мутантов с генетическим повреждением структурных цистронов, контролирующих синтез различных ферментов репарирующей системы. Ихиспользование в значительной мере способствовало выяснению внутренних механизмов темновой репарации.
Необходимо отметить, что разнообразные пострадиационные воздействия, препятствующие репликации ДНК и делению клеток — длительное (несколько часов) выдерживание в средах, лишенных источников полноценного питания (вода, буфер, физиологический раствор, синтетические среды без глюкозы или азотистых веществ), добавление ингибиторов макромолекулярных синтезов и дыхания и т. д., снижают степень биологического повреждения их благодаря созданию оптимальных условий для работы системы темновой репарации.
Система темновой репарации клетки-хозяина устраняет также фотохимические повреждения ДНКбактериофагов.
С другой стороны, бактериофаги не восстанавливаются системой темновой репарации клетки-хозяина, но их геном содержит специальные гены, определяющие синтез в клетке-хозяине особых репарирующих ферментов.
Наконец, у вирусов описано явление неспецифической репарации — множественной и перекрестной реактивации, прямо не связанной с системой темновой репарации. Обнаруженная Лурия множественная реактивация заключается в восстановлении жизнеспособности фагов при инфицировании клетки большим числом убитых ультрафиолетовым светом фагов, когда из инактивированных фаговых частиц образуется полноценное потомство. Под перекрестной реактивацией понимают восстановление жизнеспособности убитого фага при множественном инфицировании клетки этим фагом и другим, необлученным, отличающимся от первого своим геномом. Это явление нередко называют «спасением маркеров».Воснове множественной и перекрестной реактивации лежит реконструкция интактной ДНК из неповрежденных фрагментов нескольких молекул ДНК фагов в ходе генетической комплементации и рекомбинации.
Список литературы
1. А.С.Коничев, Г.А.Севастьянова Молекулярная биология. – Москва.: Академия, 2003
2. Зенгбуш П., Молекулярная и клеточная биология, пер. с нем., т. 1, М., 1982, с. 183-215
3. Страйер Л., Биохимия, пер. с англ., т. 3, М., 1985, с. 196-216.
4. И. М. Спивак. Экология. Повреждение и Репарация ДНК. – Санкт-Петербург.: Изд. Политехнического университета. 2006
5. Википедия. Репарации. [Электронный ресурс]. Режим доступа: https://ru.wikipedia.org/wiki/%D0%A0%D0%B5%D0%BF%D0%B0%D1%80%D0%B0%D1%86%D0%B8%D1%8F_%D0%94%D0%9D%D0%9A. Дата доступа: 21.03.2018
|
из
5.00
|
Обсуждение в статье: Характеристика световой и темновой репарации, SOS – репарации, прямой репарации. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

