 |
Главная |
Примерный перечень контрольных вопросов для экзамена
|
из
5.00
|
1. Термодинамическая система, параметры ее состояния. Экстенсивные и интенсивные свойства системы, изменение свойств системы. Трактовка понятий "работа" и "теплота" как характеристик процесса. Первый закон термодинамики. Формулировка и уравнения первого закона термодинамики.
2. Тепловые эффекты Qp и Qv, их связь с изменением внутренней энергии и энтальпии системы. Закон Гесса и следствия из него.
3. Теплоемкость и зависимость ее от температуры. Связь между 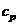 и
и 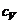 .
.
4. Зависимость теплового эффекта реакции от температуры в дифференциальной и интегральной формах.
5. Термодинамическая вероятность и энтропия. Связь изменения энтропии с теплотой процесса. Определение направления процессов и условий равновесия по изменению энтропии в адиабатических условиях.
6. Зависимость энтропии от давления и температуры системы.
7. Энергия Гельмгольца (F) иэнергия Гиббса (G). Определение направления процессов и условий равновесия по изменению энергии Гиббса иэнергии Гельмгольца. Связь 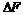 и
и 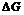 с работой обратимого процесса. Зависимость энергии Гиббса от температуры и давления. Фугитивность.
с работой обратимого процесса. Зависимость энергии Гиббса от температуры и давления. Фугитивность.
8. Стандартные состояния вещества. Изменение энергии Гиббса при переходе веществ из стандартного состояния в произвольно заданное. Активность вещества. Уравнение изотермы реакции и определение направления реакции в заданных условиях.
9. Зависимость константы равновесия оттемпературы (уравнение изобары химической реакции).
10. Расчет константыравновесия химической реакции при различных температурах. Принцип смещения равновесия при внешнем воздействии на систему.
11. Растворы. Определение. Способы выражения состава раствора. Парциально-молярные свойства компонентов раствора. Основное уравнение для парциально-молярных свойств (Гиббса-Дюгема) и следствия из него.
12. Методы определения парциально-молярных свойств компонентов в растворах.
13. Теплоты растворения: дифференциальная и интегральная. Знаки теплот смешения и соотношение энергий одноименных и разноименных связей. Связь теплот растворения с теплотами агрегатных превращений и сольватации.
14. Идеальные растворы. Закон Рауля. Парциально-мольные свойства компонентов в идеальных растворах. Изменение парциально-мольной энтропии и химического потенциала при переходе компонента в идеальный раствор. Активность компонента в идеальном растворе.
15. Бесконечно разбавленные растворы. Законы Рауля и Генри. Активность растворителя и растворенного вещества в бинарном растворе.
16. Реальные растворы. Химический потенциал, активность и коэффициент активности компонента раствора. Способы выбора стандартного состояния компонента раствора.
17. Гетерофазные равновесия. Определение фазы, числа компонентов и числа степеней свободы термодинамической системы. Вывод правила фаз и частные случаи его применения. Принцип расчета равновесного состава гетерогенных систем с несколькими химическими равновесиями.
18. Фазовые превращения индивидуальных веществ. Зависимость температуры фазового перехода от давления. Зависимость давления насыщенного пара над конденсированным веществом от температуры. Фазовые диаграммы однокомпонентных систем.
19. Фазовые превращения с участием растворов. Растворимость, ее зависимость от температуры.
20. Температура начала кристаллизации растворителя из идеальных растворов. Равновесие твердого и жидкого идеальных растворов.
21. Кристаллизация растворителя из бесконечно разбавленного раствора. Криоскопия. Определение молярной массы растворенного вещества и степени его диссоциации.
22. Диаграммы состояния двухкомпонентных систем. Системы с эвтектикой. Порядок кристаллизации. Правило рычага. Построение диаграмм состояния, термический анализ.
23. Скорость гомогенной химической реакции. Зависимость скорости реакции от концентрации реагентов. Порядок и молекулярность реакции.
24. Зависимость концентрации реагирующих веществ от времени дляреакций различного порядка. Период полупревращения.
25. Методы определения порядка химической реакции.
26. Зависимость скорости реакции от температуры. Теория активных столкновений. Энергия активации. Вероятностный (стерический) фактор. Экспериментальное определение энергии активации.
27. Гомогенный катализ. Причины ускорения реакций в присутствии катализатора. Зависимость скорости реакции от концентрации катализатора. Влияние катализатора на механизм процесса.
28. Особенности диффузии в твердых телах, в жидкостях и газах. Молекулярная и конвективная диффузия. Законы Фика. Коэффициент диффузии и его зависимость от температуры.
29. Кинетическое уравнение гетерогенной реакции первого порядка. Частные случаи. Факторы, влияющие на скорость реакции в различных режимах процесса. Экспериментальное определение режима гетерогенной реакции.
|
из
5.00
|
Обсуждение в статье: Примерный перечень контрольных вопросов для экзамена |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

