 |
Главная |
Основные законы формальной кинетики: уравнение Аррениуса, закон действующих масс.
|
из
5.00
|
Эндо- и экзотермические реакции. Влияние катализатора на энергетическое состояние химической реакции.
Чтобы молекулы начали превращаться необходима определенная энергия для преодоления потенциального барьера.
Конфигурация промежуточных комплексов похожа на конфигурацию веществ в реакционной смеси, к которому он ближе по энергии Гиббса. Для экзотерм. реакции промежуточный комплекс по строению схож с исходными веществами, а для эндот. – с продуктами реакции.
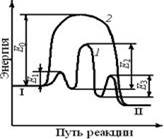
1- путь реакции без катализатора
2- путь каталитической реакции
Энергетический уровень:
I- исходных веществ
II- продуктов реакции
Пусть протекает одностадийная реакция с Е0:
А+В→ R
Ход этой реакции на кривой изображен 1. Присутствие катализатора механизм реакции меняется, и она протекает через несколько стадий - 2 стадия.
Первой стадией является образование промежуточного активированного комплекса:
А+К→АК
Затем активированный комплекс взаимодействует со вторым компонентом с образованием комплекса катализатора и продукта
АК+В→RК
Последней стадией является разложение комплекса с образованием продукта R и высвобождением катализатора для нового каталитического комплекса
RК  R+К
R+К
Каждая из этих последовательных стадий характеризуется своими значениями энергиями актив Е1, Е2, Е3, но высота каждого из этих потенциальных барьеров ниже Е0. Т.о., в присутствии катализатора реакция протекает энергетически по более выгодному пути, что позволяет её проводить при большей скорости. Однако исходное и конечное состояние системы (I и II) в присутствии катализатора и без него одинаковы. Следовательно, роль катализатора состоит в изменение скорости достижения состояния равновесия.
Чтобы молекулы начали превращаться необходимо определенная энергия для преодоления потенциального барьера.
Конфигурация промежуточных комплексов похожа на конфигурацию веществ в реакционной смеси, к которому он ближе по энергии Гиббса. Для экзотерм. реакции промежуточный комплекс по строению схож с исходными веществами, а для эндот. – с продуктами реакции.
Основные законы формальной кинетики: уравнение Аррениуса, закон действующих масс.
Хим. Кинетика – учение о скоростях и механизмах хим. Реакций.
Проведение кинетического анализа связано с изучением скоростей образования продуктов реакции и расходования исходных веществ и получение зависимости между скоростью хим. реакции и технологическими параметрами. Конечной целью кинетического исследования является составление кин. модели процесса, которая включает в себя систему кин. уравнений, описывающих изменение состояния реакционной смеси от кин. параметров (р, Т, С, ЕА).
ЗДМ: Скорость простой элементарной реакции прямо пропорциональна концентрации реагирующих веществ в соответствующих степенях, называемых порядком реакции.
Молекулярность реакции – количество веществ, одновременно реагирующих в простой элементарной реакции (1, 2, 3).
Константа скорости – скорость хим. реакции при постоянных текущих концентрациях всех реагентов, равных 1.
Уравнение Аррениуса: 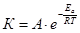
А – предэкспонента (энтропийный фактор) показывает зависимость скорости хим. реакции от конфигурации молекул и лобильных комплексов.
- Теоретические основы процесса алкилирования бензола этиленом. Технология производства этилбензола в присутствии Al Cl3
Процесс алкилирования- это введение алкильной группы в парафиновые,нафтеновые или аромат.соединения.Этилбензол получ.введением этильной группы в бензол. Агентом может выступать хлорэтил или этилен. Аналогичным является процесс получения изопропилбензола.Процесс алкилирования-каталитический. Использ-ся катионные катализаторы, такие как серная кислота, фосфорная к-та, BF3, алюмосиликаты и хлористый алюминий. В зависимости от катализатора процесс протекает в гомогенной или гетерогенной фазе, от этого зависит температура, давление, допустимые примеси. Механизм р-ии алкилирования: Хлористый Аl образует ионизированную комплексную соль с хлористым алкилом или HCl, кот.явл.сокатализаторами:
 Al Cl3 + H Cl→Al Cl4- H +
Al Cl3 + H Cl→Al Cl4- H +
+ Al Cl4- H + →[ Al Cl4-] – сопряженная кислота Льюиса (n С6Н6 m R2 C6H4)
 Диэтилбензол возвращается в процесс,чтобы обеспечить р-ю переалкилиров.наряду с прямой реакцией алкилирования.
Диэтилбензол возвращается в процесс,чтобы обеспечить р-ю переалкилиров.наряду с прямой реакцией алкилирования.
Установка получения этилбензола:Готовой продукцией этой установки явл.этилбензол,жидкий у/в с темпер.кипения 136С.Использ-ся как сырье для получ.стирола.Исходным сырьем явл.бензол и этилен полученные на установке ЭП-450 в качестве катал.исп.привозной AlCl3.Инициатором в процессе явл.хлористый этил.СH3- CH2- Cl – CH2=CH.Температура алкилирования 130С,давление 3атм.,тепловой эффект 10В кДж/моль.В рез-те указанных р-ций устанавл-ся опред-ый состав продуктов зависящий от соотношения алкильных радикалов и бензольных ядер,т.е.от соотношения С6H6 и С2H4,кот.обычно задаются 3:1,т.е.C6H6всегда берется больше.Образующаяся в результате алкилирования реакционная масса обычно содержит 60%непрореаг.C6H6,30%этилбензола,10%полиалкилбензолов и полиалкилбензольной смолы.Каt процесса готов-ся в отдельном аппарате с мешалкой при t=50С и атм.давлении. Туда подается осушенный С6H6,полиалкилбензолы,хлорный этил и АlCl3.Образов.каталит-ий комплекс подается в реактор алкилирования,туда же поступает бензол,ПАБЫ,этилен. Системе в реакторе явл.3-хфазной:2жидкие,1-газообр-я.Р-я алкилирования идет с выделением тепла,кот.снимается циркулирующим комплексом и испаряющимся С6H6
3. Уравнение постоянства расхода жидкости
При условии недеформируемости и непроницаемости стеноктрубопровода и отсутствии разрывов и пустот можно записать (для стационарного режима):
 - уравнение неразрывности (сплошности) потока, или постоянства расхода жидкости. Для любых поперечных сечений стационарного потока жидкости массовый ее расход постоянен. Уравнение постоянства расхода выражает материальный баланс потока и является частным случаем закона сохранения массы.
- уравнение неразрывности (сплошности) потока, или постоянства расхода жидкости. Для любых поперечных сечений стационарного потока жидкости массовый ее расход постоянен. Уравнение постоянства расхода выражает материальный баланс потока и является частным случаем закона сохранения массы.
Для несжимаемой жидкости (ρ=const): V= w · S
Для 2х произвольных поперечных сечений потока можно записать:
 или
или  , т.е. средние скорости потока обратно пропорциональны живому сечению потока или квадрату диаметра трубы.
, т.е. средние скорости потока обратно пропорциональны живому сечению потока или квадрату диаметра трубы.
- Задача

|
из
5.00
|
Обсуждение в статье: Основные законы формальной кинетики: уравнение Аррениуса, закон действующих масс. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

