 |
Главная |
Особенности выделения белков
|
из
5.00
|
ВЫДЕЛЕНИЕ БЕЛКОВ
Выделение практически чистого индивидуального белка (в таких случаях нередко употребляют не вполне удачный термин "гомогенный белок") — необходимая предпосылка для изучения его строения и функциональных свойств. Технические приемы, используемые для этого, весьма многообразны и быстро совершенствуются, причем наряду с развитием микрометодов все чаще возникает необходимость масштабирования процессов, с тем, чтобы получать крупные количества высокоочищенных белков для нужд медицины и биотехнологии. Особенно обострилась потребность в эффективных методах разделения белков с развитием генно-инженерных способов их получения. В данной главе рассмотрены лишь наиболее общие принципы препаративной химии белков.
Особенности выделения белков
Получение чистых химических индивидуальных белков включает в себя как удаление небелковых примесей, так и разделение между собой собственно белковых компонентов. Последняя часть задачи в силу сходства физико-химических свойств белков особенно сложна, поэтому именно ее решение определяет выбор тех или иных схем выделения белка. При этом необходимо учитывать некоторые особенности поведения, присущие всем белкам.
К ним относится, прежде всего, способность белков подвергаться денатурации, т.е. претерпевать такие изменения пространственного строения, которые приводят к утрате или частичной потере функциональных свойств. Правда, денатурация во многих случаях обратима, однако эта обратимость не обеспечивается автоматически, а требует в каждом отдельном случае подбора специальных приемов. В то же время полностью или даже частично денатурированные белки весьма уязвимы для необратимых повреждений, в особенности для действия протеолитических ферментов, поэтому условий, способствующих денатурации, следует всемерно избегать.
Для предотвращения тепловой денатурации выделение белка проводят при низкой температуре,обычно при 4 ºС. Необходимо также избегатькрайних значенийpH. Белки легко денатурируют при низких рН из-за протонирования отрицательно заряженных в нормальных условиях карбоксильных групп и возникающего вследствие этого резкого преобладания положительных зарядов, которое благоприятствует развертыванию компактной структуры. В щелочной среде при рH 10 и выше утрачиваются положительные заряды, обусловленные протонированием ε-аминогрупп лизина, и опять-таки наступает декомпенсация зарядов на поверхности, дестабилизирующая глобулу. Одновременно фенольные гидроксилы тех остатков тирозина, которые были скрыты внутри глобулы, получив отрицательный заряд, стремятся выйти на поверхность, что также способствует денатурации белка.
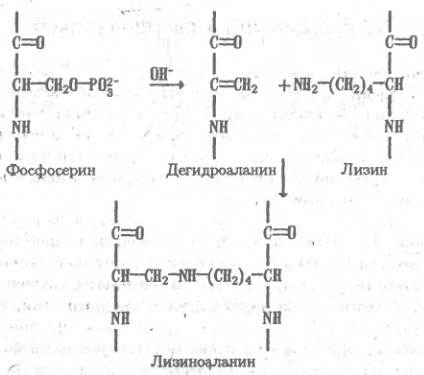
В еще более щелочных растворах происходят реакции, необратимо повреждающие белок, — отщепление серы от остатков цистеина и цистина, β-элиминирование фосфатных остатков в фосфопротеинах, отщепление полисахаридных цепей, присоединенных к остаткам серина в гликопротеинах. Образующиеся в результате этих реакций остатки непредельной аминокислоты — дегидроаланина— присоединяются кблизлежащим ε-аминогруппам лизина с образованием так называемого лизиноаланина— соединения, присутствие которого в кислотном гид-ролизате белка свидетельствует о глубоком повреждении его структуры.
Причиной денатурации может стать применение органических растворителей,способных нарушить существенную для стабильности белка систему гидрофобных контактов внутри глобулы. Надо также учитывать возможность денатурации белка на границе раздела фаз, В особенности при образовании пены. При выделении очень малых количеств белка, не редком в современной биохимии, следует считаться с потерями, вызываемыми его адсорбцией, часто необратимой, на поверхности стекла или полимерных материалов, особенно значительной на заключительных стадиях очистки.
Особую опасность при выделении белков представляют содержащиеся в исходном материале протеолитические ферменты, даже если они присутствуют в следовых количествах. Повреждение, которое приводит к образованию ложных множественных форм белка, а иногда и его глубокое расщепление становятся особенно вероятными, если схема выделения включает условия, приближающие белок к денатурации. Для предотвращения протеолиза необходимо уже на ранних стадиях очистки включать операции, направленные на отделение протеиназ, прибавлять к смеси ингибиторы различных классов протеиназ. Очень важно проводить очистку белка быстро, что снижает опасность протеолиза и вероятность денатурации.
Распространено мнение об особой нестабильности чистых белков.Действительно, содержащиеся в неочищенных препаратах посторонние белки в определенной мере защищают белок от денатурирующих воздействий и протеолиза. На промежуточных стадиях, когда полная
очистка еще не достигнута, опасность протеолиза увеличивается, с удалением же следов протеиназ на завершающих этапах очистки стабильность белка должна вновь возрасти. Впрочем, возрастает и опасность сорбционных потерь на поверхностях, которые могут восприниматься экспериментатором как присущая чистому белку нестабильность.
|
из
5.00
|
Обсуждение в статье: Особенности выделения белков |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

