 |
Главная |
Молекулярно-кинетическая теория идеальных газов
|
из
5.00
|
Тепловое равновесие.
Температура. Шкала температур Цельсия.
Молекулярная физика и термодинамика изучают свойства и поведение макроскопических систем, т.е. систем, состоящих из огромного числа атомов и молекул. Типичные системы, с которыми мы сталкиваемся в повседневной жизни, содержат около 1025 атомов.
При исследовании таких систем важнейшими являются макроскопические величины, непосредственно измеряемые опытным путём и характеризующие свойства всей совокупности молекул в целом. Учитывая необычайную сложность макросистем, следует начать изучение с наиболее простых объектов – систем, состояние которых не меняется со временем. Состояние макроскопической системы, в котором она может находится неопределённо долгое время, называется равновесным (о нём говорят также, как о состоянии теплового равновесия).
Равновесное состояние системы в целом может быть описано при помощи величин, называемых макроскопическими параметрами, к числу которых относят давление, объем и т. д. Каждый из параметров характеризует некоторое свойство системы. Так объем V мера свойства системы занимать ту или иную область пространства; давление Р – мера свойства системы сопротивляться внешнему изменению ее объёма.
В состоянии теплового равновесия макроскопические параметры не меняются со временем, остаются постоянным.
Одним из наиболее важных параметров, характеризующих равновесные свойства макроскопической системы, является температура. Введем этот параметр, для чего рассмотрим два тела, которые могут взаимодействовать и обмениваться энергией. Этот тип взаимодействия, который называется тепловым, приводит к тому, что в результате столкновений молекул в области контакта двух тел происходит передача энергии от быстрых молекул к медленным. Это означает, что энергия движения атомов в одном теле уменьшается, в другом – увеличивается. Тело, которое теряет энергию, называют более нагретым, а тело, к которому энергия переходит – менее нагретым. Такой переход энергии продолжается до тех пор, пока не установится состояние теплового равновесия. В состоянии теплового равновесия степени нагретости тел одинаковы. Для характеристики степени нагретости тела вводят параметр, называемый температурой.
Из опыта известно, что при изменении температуры изменяются размеры тел, электрическое сопротивление и другие свойства. Таким образом, температуру можно определить по изменению какого-либо удобного для измерения физического свойства данного вещества.
Чаще всего для измерения температур используют свойство жидкости изменять объем при нагревании и охлаждении. Прибор, с помощью которого измеряется температура, называется термометром.
Обыкновенный жидкостной термометр состоит из небольшого стеклянного резервуара, к которому присоединена стеклянная трубка с узким внутренним каналом. Резервуар и часть трубки наполнены ртутью или другой жидкостью. Температуру среды, в которую погружен термометр, определяют по положению верхнего уровня ртути в трубке. Деления на шкале условились наносить следующим образом. Цифру 0 ставят в том месте шкалы, где устанавливается уровень столбика жидкости, когда термометр опущен в тающий снег, цифру 100 – в том месте, где устанавливается уровень столбика жидкости, когда термометр погружен в пары воды, кипящей при нормальном давлении (105 Па). Расстояние между этими метками делят на 100 равных частей, называемых градусами. Такая температурная шкала создана Цельсием. Градус по шкале Цельсия обозначают °С.
Кроме макроскопических параметров вводят параметры системы, связанные с индивидуальными характеристиками составляющих её частиц, называемые микроскопическими. К их числу относятся в первую очередь масса частиц, их скорость, кинетическая энергия.
Идеальный газ. Основное уравнение молекулярно-кинетической теории идеального газа.
Теория создана немецким физиком Р. Клаузисом в 1957 году для модели реального газа, которая называется идеальный газ. Основные признаки модели:
расстояния между молекулами велики по сравнению с их размерами;
взаимодействие между молекулами на расстоянии отсутствует;
при столкновениях молекул действуют большие силы отталкивания;
время столкновения много меньше времени свободного движения между столкновениями.
Молекулярно-кинетическая теория (МКТ) устанавливает связи между макро- и микропараметрами идеального газа. Основное уравнение МКТ выражает выражает связь давления газа со средней кинетической энергией поступательного движения молекул. Давление газа на стенки сосуда является результатом многочисленных ударов молекул. При каждом ударе стенка получает силовой импульс, величина которого зависит от скорости молекул и, следовательно, от энергии их движения. При огромном числе ударов создается постоянное давление газа на стенку. Число ударов зависит от концентрации молекул n. Таким образом, можно ожидать, что давление газа связано с концентрацией молекул и с энергией их движения. Получим основное уравнение МКТ.
Рассмотрим сферический объём радиуса R, в котором находится N молекул идеального газа. Рассмотрим движение одной из них. Допустим, что молекула двигалась прямолинейно с импульсом  ударилась о стенку под углом ψ к нормали и отскочила от неё под тем же углом, имея импульс
ударилась о стенку под углом ψ к нормали и отскочила от неё под тем же углом, имея импульс  . Найдём импульс, переданный молекулой стенке при ударе. Из закона сохранения импульса:
. Найдём импульс, переданный молекулой стенке при ударе. Из закона сохранения импульса:

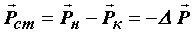
Т. к. удар упругий,  и
и  = 0, поэтому
= 0, поэтому  направлен по нормали к стенке и по модулю равен:
направлен по нормали к стенке и по модулю равен:
 .
.
Путь, который молекула проходит от одного удара о стенку до другого, равен хорде АВ, т. е. величине 2Rcosψ.
Найдем число ударов молекулы о стенку за одну секунду. Оно равно отношению скорости молекулы  к пути, проходимому молекулой от одного столкновения со стенкой до другого:
к пути, проходимому молекулой от одного столкновения со стенкой до другого:
 .
.
Сталкиваясь со стенками сосуда, одна молекула за одну секунду сообщает ей импульс

Суммарный импульс, сообщенный всеми N молекулами стенке сосуда за одну секунду будет равен
 .
.
Из II закона Ньютона следует, что импульс, сообщённый за единицу времени стенке, численно равен силе, поэтому сила давления, действующая на поверхность сосуда, равна
 .
.
Давление найдём, разделив силу на площадь поверхности сферического сосуда:
 ,
,
где  – объём сосуда с газом.
– объём сосуда с газом.
Перепишем полученное равенство в виде:

Помножив и поделив правую часть на число молекул N в объёме V, получим:
 или
или  (9)
(9)
Здесь введена величина 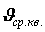 – средняя квадратичная скорость, равная корню квадратному из суммы квадратов всех скоростей, делённой на число молекул:
– средняя квадратичная скорость, равная корню квадратному из суммы квадратов всех скоростей, делённой на число молекул:
 . (10)
. (10)
Тогда
 , (11)
, (11)
где n  –концентрация молекул.
–концентрация молекул.
Это уравнение называется основным уравнением молекулярно-кинетической теории идеального газа.
Получим связь давления со средней кинетической энергией поступательного движения молекулы
 . (12)
. (12)
Из формулы (11)  , следовательно:
, следовательно:
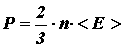 . (13)
. (13)
Таким образом, давление идеального газа пропорционально произведению концентрации молекул на среднюю кинетическую энергию поступательного движения молекулы. Это утверждение можно считать другой формулировкой основного уравнения молекулярно-кинетической теории идеального газа.
Закон Дальтона.
Рассмотрим газ, состоящий из молекул различных веществ, который находится в объёме V. Вследствие хаотического теплового движения молекулы каждой компоненты смеси будут распределены по объёму равномерно, т.е. так как если бы остальные компоненты газа отсутствовали. Из–за постоянных соударений молекул друг с другом, сопровождающихся частичным обменом между ними импульсами и энергиями, в смеси устанавливается тепловое равновесие. Всё это приводит к тому, что давление каждой из компонент смеси не будет зависеть от присутствия остальных.
Тогда результирующее давление определяется суммарным давлением всех компонентов, т.е. для смеси газов справедлив закон Дальтона: давление смеси идеальных газов равно сумме парциальных давлений входящих в нее газов.
 , (14)
, (14)
где k – номер газовой компоненты в смеси, Pk – ее парциальное давление, т.е. то давление, которое имел бы k–ый газ, если бы только он один занимал весь объём, занимаемый смесью.
Средняя квадратичная скорость молекул.
Из основного уравнения молекулярно-кинетической теории можно получить формулу для расчета средней квадратичной скорости молекул
 .
.
Произведение массы одной молекулы m0 на число молекул в единице объема n равно плотности вещества r : = r m0×n.
Таким образом,  . Отсюда следует, что
. Отсюда следует, что
 . (15)
. (15)
кспериментальные газовые законы
Изопроцессы. Законы Бойля-Мариотта, Гей-Люссака, Шарля.

Всякое изменение состояния газа называется термодинамическим процессом.
Простейшими процессами в идеальном газе являются изопроцессы. Это процессы, при которых масса газа и один из его параметров состояния (температура, давление или объем) остаются постоянными.
Изопроцесс, протекающий при постоянной температуре, называется изотермическим.
Экспериментально Р. Бойлем и Э. Мариоттом было установлено, что при постоянной температуре произведение давления газа на объем для данной массы газа есть величина постоянная (закон Бойля–Мариотта):
 (16)
(16)
Графически этот закон в координатах РV изображается линией, называемой изотермой (рис.1).

Изопроцесс, протекающий в идеальном газе, в ходе которого давление остается постоянным, называется изобарным.
Зависимость объема газа от его температуры при постоянном давлении была установлена Л. Гей-Люссаком, который показал, что объем газа данной массы при постоянном давлении возрастает линейно с увеличением температуры (закон Гей-Люссака):
V = V0·(1 + ·t), (17)
где V – объем газа при температуре t, °С; V0 – его объем при 0°С.
Величина  называется температурным коэффициентом объемного расширения. Для всех газов = (1273°С–1). Следовательно,
называется температурным коэффициентом объемного расширения. Для всех газов = (1273°С–1). Следовательно,
V = V0·(1 +  ·t). (18)
·t). (18)
Графически зависимость объема от температуры изображается прямой линией – изобарой (рис. 2). При очень низких температурах (близких к – 273°С) закон Гей–Люссака не выполняется, поэтому сплошная линия на графике заменена пунктиром.

Изопроцесс, протекающий в газе, при котором объем остается постоянным, называется изохорным.
Исследования зависимости давления данной массы газа от температуры при неизменном объеме были впервые проведены французским физиком Шарлем. Им было установлено, что давление газа данной массы при постоянном объеме возрастает линейно с увеличением температуры (закон Шарля):
P = P0(1+  t). (19)
t). (19)
Здесь P – давление газа при температуре t, °С; P0 – его давление при 0 °С.
Величина  называется температурным коэффициентом давления. Ее значение не зависит от природы газа; для всех газов
называется температурным коэффициентом давления. Ее значение не зависит от природы газа; для всех газов  = 1/273 °С–1. Таким образом,
= 1/273 °С–1. Таким образом,
P = P0(1 +  ·t). (20)
·t). (20)
Графическая зависимость давления от температуры изображается прямой линией – изохорой (Рис. 3).
Абсолютная шкала температур.
Если изохору продолжить в область отрицательных температур, то в точке пересечения с осью абсцисс имеем
P = P0(1 +  ·t) = 0. (21)
·t) = 0. (21)
Отсюда температура, при которой давление идеального газа обращается в нуль, t = –273°С (точнее,–273,16°С). Эта температура выбрана в качестве начала отсчета термодинамической шкалы температур, которая была предложена английским ученым Кельвиным. Эта температура называется нулем Кельвина (или абсолютным нулем).
Температура, отсчитанная по термодинамической шкале температур, обозначается Т. Ее называют термодинамической температурой. Так как точка плавления льда при нормальном атмосферном давлении, принятая за 0°С, равна 273,16 К–1, то
Т = 273,16 + t. (22)
Уравнение Клайперона.
Получим другую форму уравнений, описывающих изобарный и изохорный процессы, заменив в уравнениях (18) и (20) температуру, отсчитанную по шкале Цельсия, термодинамической температурой:
V = V0(1 + 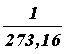 ·t) = V0(
·t) = V0(  ) = V0
) = V0 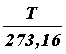
Обозначив объемы газа при температурах Т1 и Т2, как V1 и V2, запишем
V1 = V0  , V2 = V0
, V2 = V0 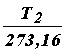 .
.
Разделив почленно эти равенства, получим закон Гей - Люссака в виде
V1/V2 = Т1/Т2
или
 = сonst. (23)
= сonst. (23)
Аналогично получим новую форму закона Шарля :
 (24)
(24)
Законы Шарля и Гей-Люссака можно объединить в один общий закон, связывающий параметры P, V и T при неизменной массе газа.
Действительно, предположим, что начальное состояние газа при m = const характеризуется параметрами V1, Р1, Т1, а конечное – соответственно V2, Р2, Т2. Пусть переход из начального состояния в конечное состояние происходит с помощью двух процессов: изотермического и изобарического. В ходе первого процесса изменим давление с Р1 на Р2. Объем, который займет газ после этого перехода, обозначим V, тогда по закону Бойля–Мариотта, Р1V1 = Р2V, откуда
 (25)
(25)
На втором этапе уменьшим температуру с Т1 до Т2, при этом объем изменится от значения V до V2; следовательно по закону Шарля  откуда
откуда
 (26)
(26)
В уравнениях (25) и (26) равны левые части; следовательно, равны и правые, тогда  , или
, или
 , (27)
, (27)
т. е. можно записать, что
 . (28)
. (28)
Выражение (28) называют уравнением Клапейрона или объединённым газовым законом.
Уравнение состояния идеального газа – уравнение Менделеева-Клапейрона.
Значение входящей в уравнение (28) константы, которая обозначается как R, для одного моля любого газа одинаково, поэтому эта константа получила название универсальной газовой постоянной.
Найдем числовое значение R в СИ, для чего учтем, что, как следует из закона Авогадро, один моль любого газа при одинаковом давлении и одинаковой температуре занимает один и тот же объем. В частности при Т0 = 273K и давлении Р0 = 105 Па объем одного моля газа равен V0 = 22,4·10–³ м³. Тогда R =  = 8,31 Дж/(моль· К).
= 8,31 Дж/(моль· К).
Уравнение (28) для одного моля газа можно записать в виде
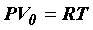 . (29)
. (29)
Из уравнения (29) легко получить уравнение для любой массы газа. Газ массой m займет объем V = V0(m/M), где М – масса 1 моль, m/M – число молей газа. Умножив обе части уравнения (29) на m/M, получим  .
.
Так как  , то окончательно получаем
, то окончательно получаем
 . (30)
. (30)
Уравнение (30) называется уравнением Менделеева – Клапейрона и является основным уравнением, связывающим параметры газа в состоянии теплового равновесия. Поэтому его называют уравнением состояния идеального газа.
Температура - мера средней кинетической энергии
Сравнивая уравнение состояния идеального газа и основное уравнение кинетической теории газов, записанные для одного моля (для этого число молекул N возьмём равным числу Авогадро NА), найдём среднюю кинетическую энергию одной молекулы:
 и
и  .
.
Откуда
 . (31)
. (31)
Средняя кинетическая энергия поступательного движения молекулы не зависит от её природы и пропорциональна абсолютной температуре газа T. Отсюда следует, что абсолютная температура является мерой средней кинетической энергии молекул.
Величина R/NА = k в уравнении (31) получила название постоянной Больцмана и представляет собой газовую постоянную, отнесенную к одной молекуле:
k = 1,38·10-23 Дж/К-23.
Так как  =
=  kТ, то средняя квадратичная скорость равна
kТ, то средняя квадратичная скорость равна
 . (32)
. (32)
Подставляя значение средней кинетической энергии поступательного движения молекул (31) в основное уравнение молекулярно–кинетической теории газов, получим другую форму уравнения состояния идеального газа:
P = n0kT. (33)
Давление газа пропорционально произведению числа молекул в единице объема на его термодинамическую температуру.
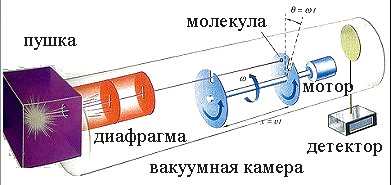
На рис. приведена схема опыта Штерна для определения скорости молекул газа.
В нагревателе с поверхности проволоки, раскаленной электрическим током, испаряются атомы серебра. Попадая из нагревателя через отверстие в вакуумную камеру, молекулы пара с помощью системы щелей формируются в узкий пучок, направленный в сторону двух дисков, вращающихся с угловой скоростью .Диски используются для сортировки молекул по скоростям. Угол между прорезями в дисках . Расстояние между дисками X в процессе эксперимента не изменяется. Для того, чтобы молекула пара попала на приемник детектора частиц, она должна пройти через прорези в дисках. Для этого время прохождения молекулы, движущейся со скоростью V между дисками, должно быть равно времени поворота прорези второго диска на угол .
Поэтому
V=· X
Список литературы
Коган М.Н. Динамика разреженного газа. М., Физматлит, 1999
Кикоин А.К., Кикоин И.К. Молекулярная физика. М., Физматлит, 1976
Сивухин Д.В. Общий курс физики, т. 2. Термодинамика и молекулярная физика. М., Физматлит, 1989
|
из
5.00
|
Обсуждение в статье: Молекулярно-кинетическая теория идеальных газов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

