 |
Главная |
Уравнение Клаузиуса — Клапейрона
|
из
5.00
|
Клаузиус показал, как можно упростить уравнение Клапейрона для случаев испарения и возгонки, исходя из предположения, что пар подчиняется закону идеального газа и что мольным объемом жидкости  (ж) по сравнению с мольным объемом пара
(ж) по сравнению с мольным объемом пара  (пар) можно пренебречь. Например, для воды при 100° V(пар) =30.2 л а V(ж)=0,0188 л. Подставляя RT/Р вместо V (пар), получим
(пар) можно пренебречь. Например, для воды при 100° V(пар) =30.2 л а V(ж)=0,0188 л. Подставляя RT/Р вместо V (пар), получим
 (28)
(28)
После преобразования выражение принимает вид:
 (29)
(29)
 (30)
(30)
Интегрирование в предположении, что  не зависит от температуры, дает:
не зависит от температуры, дает:
 (31)
(31)
 (32)
(32)
 (33)
(33)
где С — константа интегрирования.
Теперь очевидна теоретическая основа эмпирического соотношения 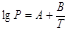 . Уравнение (32) представляет собой уравнение прямой линии, если рассматривать ln Р как функцию
. Уравнение (32) представляет собой уравнение прямой линии, если рассматривать ln Р как функцию  . Тангенс угла наклона прямой равен
. Тангенс угла наклона прямой равен  а при использовании десятичных логарифмов он равен
а при использовании десятичных логарифмов он равен  . Таким образом, теплоту испарения можно рассчитать с применением выражения
. Таким образом, теплоту испарения можно рассчитать с применением выражения



 (34)
(34)
Часто удобнее пользоваться уравнением, полученным при интегрировании в пределах Р2, Т2 и Р1, Т1:
 (35)
(35)
 (36)
(36)
 (37)
(37)
По этому уравнению можно рассчитать теплоту испарения, исходя из давления равновесного пара при двух различных температурах; если известны теплота испарения и давление пара при одной температуре, можно рассчитать давление пара при другой температуре при условии, что  остается постоянной. Давление можно выразить в любых единицах, но эти единицы должны быть одинаковыми для обоих давлений. Точно так же можно выбрать любые единицы энергии при условии, что
остается постоянной. Давление можно выразить в любых единицах, но эти единицы должны быть одинаковыми для обоих давлений. Точно так же можно выбрать любые единицы энергии при условии, что  и R будут выражены в одинаковых единицах. Изменение давления пара твердого вещества с температурой можно выразить с помощью уравнения (37) при условии, что температурный интервал не слишком широк. Вследствие того, что теплота возгонки твердого вещества больше, чем теплота испарения соответствующей жидкости, давление пара твердого вещества быстрее изменяется с температурой, чем давление пара соответствующей жидкости, и кривая идет круче. Дифференциальное выражение (28) можно применять, если изменения температуры и давления малы. Например, удобно пользоваться следующей формулой для внесения поправок в температуру кипения при колебаниях атмосферного давления:
и R будут выражены в одинаковых единицах. Изменение давления пара твердого вещества с температурой можно выразить с помощью уравнения (37) при условии, что температурный интервал не слишком широк. Вследствие того, что теплота возгонки твердого вещества больше, чем теплота испарения соответствующей жидкости, давление пара твердого вещества быстрее изменяется с температурой, чем давление пара соответствующей жидкости, и кривая идет круче. Дифференциальное выражение (28) можно применять, если изменения температуры и давления малы. Например, удобно пользоваться следующей формулой для внесения поправок в температуру кипения при колебаниях атмосферного давления:
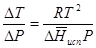 (38)
(38)
Так как уравнение (37) для расчета теплоты испарения выведено в предположении, что пар есть идеальный газ, то результаты, получаемые при пользовании этим уравнением, не более точны, чем расчеты, в которые входит уравнение  .
.
Другое приближение содержит допущение о том, что теплота испарения не зависит от температуры. Однако в широком интервале температур графики зависимости lgP от 1/Т несколько искривлены, потому что  меняется с температурой. В этом случае можно рассчитать теплоту испарения для какой-нибудь определенной температуры из наклона кривой путем проведения касательной к этой кривой при заданной температуре. Уравнение для давления равновесного пара, которое дает линейное изменение
меняется с температурой. В этом случае можно рассчитать теплоту испарения для какой-нибудь определенной температуры из наклона кривой путем проведения касательной к этой кривой при заданной температуре. Уравнение для давления равновесного пара, которое дает линейное изменение  с температурой, можно вывести следующим образом. Согласно уравнению
с температурой, можно вывести следующим образом. Согласно уравнению  зависимость мольной теплоты испарения
зависимость мольной теплоты испарения  от температуры выражается уравнением
от температуры выражается уравнением
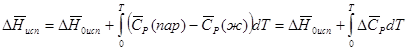 (39)
(39)
где  - гипотетическая теплота испарения при абсолютном нуле. В предположении, что
- гипотетическая теплота испарения при абсолютном нуле. В предположении, что 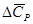 не зависит от температуры,
не зависит от температуры,
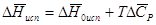
Так как разность 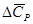 отрицательна,
отрицательна,  уменьшается по мере повышения температуры. Именно этого можно было ожидать на основании молекулярно-кинетических представлений, потому что жидкость с повышением температуры расширяется, вследствие этого расстояние между молекулами увеличивается и для их отрыва при образовании пара требуется меньше энергии.
уменьшается по мере повышения температуры. Именно этого можно было ожидать на основании молекулярно-кинетических представлений, потому что жидкость с повышением температуры расширяется, вследствие этого расстояние между молекулами увеличивается и для их отрыва при образовании пара требуется меньше энергии.
Подставляя  в уравнение (30), получим
в уравнение (30), получим

 (40)
(40)
Тогда неопределенный интеграл этого выражения равен:
 (41)
(41)
 (42)
(42)
Для определения трех констант А,В,С нужно решить систему из трех уравнений, при составлении которой необходимы точные данные при трех температурах. Уравнение (42) применимо в более широком интервале температур, чем уравнение (32), однако и оно не является точным, поскольку отклонение свойств пара от свойств идеального газа приводит к заметной ошибке, которая не учитывается при выводе уравнения.
6. Практическая часть
Вопросы
Каким правилом выражается связь между числом степеней свободы, числом фаз и числом компонентов в гетерогенной системе?
Дать понятия: гетерогенная система, фаза, составляющее вещество системы.
С помощью какого уравнения выражается связь между основными термодинамическими параметрами однокомпонентной двухфазной системы, находящейся в состоянии равновесия? Вывести это уравнение.
Свяжите составы жидкости и ее пара с общим давлением и парциальным давлением пара.
Интерпретируйте диаграмму температура – состав и используйте для ее определения поведение смеси при дистилляции.
Справедливо ли уравнение Клапейрона – Клаузиуса для фазовых переходов между твердым и газообразным агрегатными состояниями вещества? Аргументируйте свой ответ.
Что характеризует число степеней свободы равновесной термодинамической системы?
Сформулируйте основной закон фазового равновесия. Как классифицируются системы?
Охарактеризуйте однокомпонентные гетерогенные системы. Диаграмма состояния воды. Кстати, что такое фазовая диаграмма?
Что такое моно- и энантиотропные фазовые переходы? Охарактеризовать каждый из них.
Задачи
Температура кипения ртути под нормальным атмосферным давлением 357  . Теплота парообразования 283,2 Дж/г. Определить изменение упругости пара ртути при изменении температуры на 1
. Теплота парообразования 283,2 Дж/г. Определить изменение упругости пара ртути при изменении температуры на 1  вблизи температуры кипения ртути под нормальным атмосферным давлением.
вблизи температуры кипения ртути под нормальным атмосферным давлением.
Решение: используем формулу 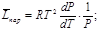 откуда
откуда
 ,
,
где  - мольная теплота испарения. Находим
- мольная теплота испарения. Находим
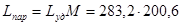 ; Т=630К
; Т=630К 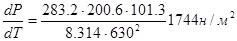 .
.
Давление паров воды при 97  равно 90919,9
равно 90919,9  , а при 103
, а при 103  112651,8
112651,8  . Определить давление паров воды при 110
. Определить давление паров воды при 110  (Р110).
(Р110).
Решение: Из формулы
 ,
,
где  - упругости паров, рассчитаем
- упругости паров, рассчитаем  .
.



Определим  , используя полученное значение
, используя полученное значение  и
и  при
при  (К).
(К).

Сравним с табличной величиной  .
.
3. Удельная теплота плавления нафталина при его нормальной температуре плавления 79,9  равна 149,25 Дж/г. Разность удельных объемов в жидком и твердом состояниях при температуре плавления
равна 149,25 Дж/г. Разность удельных объемов в жидком и твердом состояниях при температуре плавления  0,146
0,146  . Определить изменение температуры плавления нафталина при увеличении давления в 100 раз по сравнению с нормальным атмосферным давлением (101,325
. Определить изменение температуры плавления нафталина при увеличении давления в 100 раз по сравнению с нормальным атмосферным давлением (101,325  ).
).
Решение: Используя уравнение  , т.к. давление дано в
, т.к. давление дано в  , то изменение удельного объема нужно выразить в
, то изменение удельного объема нужно выразить в  , а теплоту плавления в Дж/кг. Поскольку
, а теплоту плавления в Дж/кг. Поскольку  - разность удельных объемов, то вместо мольной теплоты плавления можно взять удельную теплоту плавления (Дж/кг).
- разность удельных объемов, то вместо мольной теплоты плавления можно взять удельную теплоту плавления (Дж/кг).

Изменение температуры плавления  при увеличении давления в 100 раз по сравнению с нормальным атмосферным давлением (т.е. при 1,013
при увеличении давления в 100 раз по сравнению с нормальным атмосферным давлением (т.е. при 1,013 
 )=3,453
)=3,453 
 =3,5
=3,5  .
.
4. Докажите, что на диаграмме “давление – температура” линии равновесия жидкость – пар в однокомпонентной системе всегда должна иметь положительный наклон.
Решение:

 и
и  , поэтому
, поэтому

5. Как изменится точка кипения воды (100  ) при изменении атмосферного давления на 1 мм рт.ст.? При 100
) при изменении атмосферного давления на 1 мм рт.ст.? При 100  и 1 атм. теплота испарения воды 539,7
и 1 атм. теплота испарения воды 539,7  , мольный объем жидкой воды 18,78 мл, мольный объем пара 30,19 литров.
, мольный объем жидкой воды 18,78 мл, мольный объем пара 30,19 литров.
Решение:

Отсюда  .
.
6. Плотность твердого фенола 1072  , жидкого 1056
, жидкого 1056  , теплота его плавления 1,044
, теплота его плавления 1,044  Дж/кг, температура замерзания 314,2 К. Вычислите dP/dT и температуру плавления фенола при 5,065
Дж/кг, температура замерзания 314,2 К. Вычислите dP/dT и температуру плавления фенола при 5,065  Па.
Па.
Решение: по уравнению Клапейрона – Клаузиуса рассчитываем dP / dT :

Чтобы вычислить температуру плавления при заданном внешнем давлении, принимаем, что dT / dP в интервале давлений 1,0132  -5,065
-5,065  Па – величина постоянная, равная 4,214
Па – величина постоянная, равная 4,214  К/Па. Тогда
К/Па. Тогда
 и
и  .
.
7. Для каждой из следующих систем установить число компонентов
а) 
б)  где парциальное давление NH3 не обязательно равно парциальному давлению HCl.
где парциальное давление NH3 не обязательно равно парциальному давлению HCl.
в) 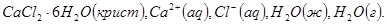
г)  где СаО и СО2 образуется при распаде СаСО3 (крист).
где СаО и СО2 образуется при распаде СаСО3 (крист).
Решение:
а) 
б) 
в) 
г) 
То, что СаО и СО2 присутствуют в стехиометрически равных Количествах, в данном случае не учитывается, т.к. это не влияет на состав фазы. Независимо от соотношения СаО и СО2 состав газообразной фазы всегда 100% СО2 , а состав тв. фазы всегда 100% СаО.
8. Данные по давлению паров чистых хлорбензола и воды даны в таблице.
t, 
| p  H2O, мм. рт. ст. H2O, мм. рт. ст.
| p  С6Н5С l , мм рт. ст. С6Н5С l , мм рт. ст.
|
| 50 | 93 | 42 |
| 60 | 149 | 66 |
| 70 | 234 | 98 |
| 80 | 355 | 145 |
| 90 | 526 | 208 |
| 100 | 760 | 293 |
| 110 | 1075 | 403 |
а) Приняв, что хлорбензол и вода в жидком состоянии полностью не смешиваются друг с другом, определить температуру, при которой хлорбензол будет перегоняться с паром при общем давлении 1 атм.
б) Каково будет содержание (вес. %) хлорбензола в дистиллате?
Решение: а)Построим график зависимости  от t (кривая 1) и график зависимости
от t (кривая 1) и график зависимости  от t (кривая 2). Исходя из этого графика, для нескольких температур откладываем
от t (кривая 2). Исходя из этого графика, для нескольких температур откладываем  и
и  , и строим зависимость (
, и строим зависимость (  +
+ 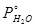 ) от t (кривая 3). Кривая 3 описывает зависимость общего давления пара системы С6Н5С l - H 2 O от температуры. Температурой кипения системы С6Н5С l - H 2 O будет температура, при которой
) от t (кривая 3). Кривая 3 описывает зависимость общего давления пара системы С6Н5С l - H 2 O от температуры. Температурой кипения системы С6Н5С l - H 2 O будет температура, при которой  +
+  =760 мм рт. ст. Как видно из графика (кривая 3), это условие выполняется при t =91,2
=760 мм рт. ст. Как видно из графика (кривая 3), это условие выполняется при t =91,2  .
.

б)  ; А= С6Н5С l , В= H 2 O . Температура кипения 92,1
; А= С6Н5С l , В= H 2 O . Температура кипения 92,1 
 мм рт. ст.;
мм рт. ст.;  мм рт. ст.; МА=113; МВ=18,0;
мм рт. ст.; МА=113; МВ=18,0;

9. Используя приведенные ниже данные, постройте диаграмму для системы хлористый натрий (S) – вода (W). Примите, что твердые растворы не образуются. Обозначьте все области.
Температура замерзания, 
| Состав насыщенного раствора, вес. % NaCl | Твердая фаза |
| 0 | 0 | W |
| -0,4 | 0,69 | W |
| -0,8 | 1,35 | W |
| -2,86 | 4,7 | W |
| -3,42 | 5,53 | W |
| -6,6 | 9,90 | W |
| -9,25 | 13,0 | W |
| -12,7 | 16,7 | W |
| -16,66 | 20,0 | W |
| -21,12(эвтектика) | 23,1 | 
|
| -14 | 24,6 | 
|
| +0,1(перитектика) | 26,3 | 
|
| 10,0 | 26,34 | S |
| 15,0 | 26,34 | S |
| 20,0 | 26,40 | S |
| 30,0 | 26,52 | S |
| 40,0 | 26,67 | S |
| 60,0 | 27,07 | S |
| 80,0 | 27,55 | S |
| 100,0 | 28,15 | S |
Решение: Построим диаграмму

10. Докажите, что для системы, изображенной на рисунке, при равновесии


W1 – вес фазы 1, W2 – вес фазы 2, х1 –вес. % В в фазе 1, х2 – вес. % В в фазе 2; хТ – вес. % В во всей системе.
Решение: Пусть W Т – общий вес всей системы. Тогда
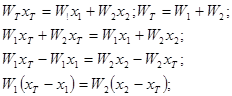
 .
.
Заключение
В введении основное внимание уделялось основным определениям фазового равновесия. Далее в работе были рассмотрены правило фаз Гиббса, равновесные состояния при фазовых переходах. К ним относятся: равновесие газ – жидкий раствор в двухкомпонентных системах; равновесие жидкость—жидкость в двухкомпонентных системах;равновесие пар—жидкий раствор в двухкомпонентных системахс ограниченной и неограниченной взаимной растворимостью жидкостей; равновесие пар—жидкий раствор в системах с взаимно нерастворимыми жидкостями. Также было рассмотреноУравнение Клаузиуса — Клапейрона, в котором Клаузиус показал, как можно упростить уравнение Клапейрона для случаев испарения и возгонки, исходя из предположения, что пар подчиняется закону идеального газа и что мольным объемом жидкости  (ж) по сравнению с мольным объемом пара
(ж) по сравнению с мольным объемом пара  (пар) можно пренебречь. В практической части к данной теме были задано ряд вопросов и 10 задач с решениями.
(пар) можно пренебречь. В практической части к данной теме были задано ряд вопросов и 10 задач с решениями.
|
из
5.00
|
Обсуждение в статье: Уравнение Клаузиуса — Клапейрона |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

