 |
Главная |
Дифференциальный метод (метод Вант-Гоффа)
|
из
5.00
|
При расчетах этим способом используют опытные данные зависимости скорости реакции от времени (кинетическое уравнение):

Из опытов, как правило, получают зависимость концентрации данного компонента от времени (кинетическую кривую) Ci= f ( τi) .
Поэтому для определения скорости реакции строят график в координатах
Ci- τi (рисунок 5). Скорость реакции в заданные моменты времени τi находят проведением касательных к экспериментальной кривой по величине тангенса угла наклона этих касательных (графическим дифференцированием):

По уравнению (25) находят К1, п1 или К2, п2 по уравнению (26).

Рисунок 5 - Графическое определение скорости реакции по кинетической кривой
В данном случае можно использовать так называемый способ логарифмирования.
Рассмотрим сначала исходные формулы.
Пусть зависимость скорости реакции (22) по первому исходному веществу А1 выражается уравнением (при условии, что остальные вещества в избытке):

где п1 - порядок реакции по первому веществу.
Прологарифмируем полученное выражение:
 (28)
(28)
Так как скорость реакции по исходному веществу является отрицательной величиной, то значение 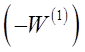 положительно. На графике в координатах
положительно. На графике в координатах  опытные точки для разных моментов времени, в случае справедливости уравнения (28) должны расположиться на прямой линии (рисунок 6). Отрезок на оси ординат дает значение ln К1, а тангенс угла наклона а прямой линии равен порядку п1 по первому веществу.
опытные точки для разных моментов времени, в случае справедливости уравнения (28) должны расположиться на прямой линии (рисунок 6). Отрезок на оси ординат дает значение ln К1, а тангенс угла наклона а прямой линии равен порядку п1 по первому веществу.

Рисунок 6 - Графическое определение порядка реакции по веществу
Скорость изменения концентрации вещества определяется непосредственно из эксперимента или из кинетической кривой (рисунок 5).
Есть и другие дифференциальные способы. Их достоинство -простота. Недостаток - большая погрешность в определении tga из
графика. Более точные результаты дают интегральные способы.
Интегральные способы
В этих способах используют выражения для зависимости концентрации веществ от времени (уравнения кинетических кривых), полученные после интегрирования уравнений вида:
 (29)
(29)
Рассмотрим некоторые интегральные способы.
1. Способ подстановки
Проинтегрируем уравнение (29) в пределах от 0 до τи от С0 до С при п = 1, 2, 3, при этом получим:
 (30)
(30)
 (31)
(31)
 (32)
(32)
где C 0 - начальная концентрация исходного вещества.
Подстановкой в эти уравнения опытных значений концентраций С исследуемого вещества, в разные моменты времени протекания реакции, вычисляют значения К. Если расчетные К, например, по уравнению (31) остаются постоянными, то это означает, что порядок реакции по веществу равен двум.
В способе подстановки для реакций 2го порядка, когда концентрации исходных веществ неравны можно использовать формулу (16).
2. Графический способ
Перепишем уравнения (30)...(32) в виде:

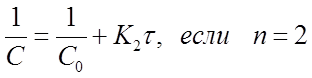

Из уравнений видно, что график, построенный по опытным данным для концентраций рассматриваемого вещества, в разные моменты времени протекания реакции, будет выражаться прямой линией в разных координатах в зависимости от порядка данной реакции по веществу. А именно:
при п=1 в координатах ln C-τ
при п = 2 в координатах 
при п=3 в координатах 
Например, если график, построенный по экспериментальным данным в координатах (  ) прямая линия, то это означает, что исследуемая реакция 2гопорядка.
) прямая линия, то это означает, что исследуемая реакция 2гопорядка.
|
из
5.00
|
Обсуждение в статье: Дифференциальный метод (метод Вант-Гоффа) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

