 |
Главная |
Особые случаи составления уравнений окислительно-восстановительных реакций
|
из
5.00
|
Рассмотренная методика составления окислительно-восстановительных реакций применима к большинству простых и сложных процессов. Но в некоторых специальных случаях необходимы дополнительные пояснения.
1. Если число электронов, отдаваемое восстановителем, и число электронов, присоединяемое окислителем, имеют общий наибольший делитель, то при нахождении коэффициентов оба числа делят на него. Например, в реакции
HCl7+O4 + 4S4+O2 + 4H2O = 4H2S6+O4 + HCl1-
основными коэффициентами для восстановителя и окислителя будут не 6 и 2, а 4 и 1.
Если число участвующих в реакции электронов нечетно, а в результате получается четное число атомов, то коэффициенты удваиваются. Например, в реакции
2Fe3+Cl3 + 2HJ1- = J20 + 2Fe2+Cl2 + 2HCl
основными коэффициентами будут не 1 и 1, а 2 и 2.
2. Окислитель или восстановитель иногда дополнительно расходуется на связывание получающихся продуктов (солеобразование).Например, в реакции
Cu + 2HNO3 + 6HNO3 = 3Cu(NO3)2 + 2NO + 4H2O
на окисление на связывание на 3 атома восстановителя Сu0 требуется для окисления 2 молекулы окислителя HNO3; кроме того, на образование нитрата меди - трех молекул - требуется еще 6 молекул HNO3 для связывания трех атомов меди. Таким образом, общий расход азотной кислоты: 2 молекулы на окисление плюс 6 молекул на связывание (солеобразование), то есть всего 8 молекул HNO3. И окончательно уравнение примет вид:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO + 4H2O.
З. Если в реакции число элементов, изменяющих свою степень окисления, больше двух, то устанавливают общее число электронов, отдаваемых восстановителями, и общее число электронов, присоединяемых окислителями, а в остальном соблюдается общий порядок составления уравнения реакции. Например,
3As3+2S2-3 + 28HN5+O3 + 4H2O ® 6H3As5+O4 + 9H2S6+O4 + 28N2+O

 2As3+ - 4e ® 2As5+ -28e 3
2As3+ - 4e ® 2As5+ -28e 3
 3S2- - 24 ® 3S6+
3S2- - 24 ® 3S6+
N5+ + 3e ® N2+ +3e 28
4. Оба элемента – и окислитель, и восстановитель – находятся в одной и той же молекуле. Это реакция внутримолекулярного окисления-восстановления и реакции диспропорционирования. Для удобства подбора коэффициентов в этом случае иногда можно рассматривать процесс как бы идущим справа налево. Например,
3HN3+O2 ® HN5+O3 + 2 N2+O + H2O
 N3+ + e ® N2+ 2
N3+ + e ® N2+ 2
N3+ - 2e ® N5+ 1
Продукты окислительно-восстановительных реакций устанавливаются опытным путём
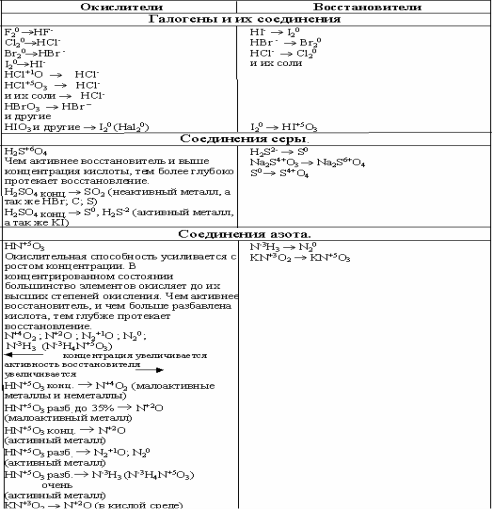
Элементы, имеющие высшую степень окисления, могут быть только окислителями.
Элементы, имеющие низшую степень окисления, могут быть только восстановителями.
Элементы, находящиеся в промежуточной степени окисления, могут и окисляться, и
восстанавливаться, то есть проявляют окислительно-восстановительную двойственностьТипичные окислители: металлы, соединения неметаллов в низшей степени окисленияТипичные восстановители: галогены, О2, N2, вещества, содержащие элемент в высшейСО.
Реакции окисления - восстановления могут протекать в различных средах: в кислой, нейтральной и щелочной. В зависимости от среды может изменяться характер протекания реакции между одними и теми же веществами. Среда влияет на изменение степеней окисления. Рассмотрим пример влияния среды на восстановление перманганат- иона MnO4
Классификация ОВР
1. К межмолекулярным относятся реакции, у которых окислитель и восстановитель находятся в разных веществах.
2. К внутримолекулярным относятся реакции, которые протекают с изменением степени окисления атомов в одной и той же молекуле.
3. К реакциям диспропорционирования, или дисмутации (самоокисления-самовосстановления), относятся реакции, сопровождающиеся одновременным увеличением и уменьшением степени окисления атомов одного и того же элемента.
Эти реакции характерны для веществ, содержащих атомы с промежуточной степенью окисления
|
из
5.00
|
Обсуждение в статье: Особые случаи составления уравнений окислительно-восстановительных реакций |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

