 |
Главная |
Способы выражения концентрации вещества в растворах
|
из
5.00
|
Сложность строения атома доказана фундаментальными открытиями, сделанными в конце XIX - начале XX веках в результате изучения природы катодных лучей (Дж.Томсон), открытия явления фотоэффекта(Столетов), открытия радиоактивности химических элементов(Беккерель, Склодавская-Кюри), определения природы а –частиц(Резерфорд). Ученые пришли к выводу о том, что атомы имеют сложное строение и обладают собственной структурой.
Модели строения атома. В 1911 г. Э. Резерфорд предложил планетарную модель атома. Она так называется, т. к. электроны вращаются вокруг ядра подобно планетам солнечной системы. Резерфорд доказал, что положительный заряд и практически вся масса атома сконцентрированы в малой части его объема – ядре, вокруг которого двигаются электроны.
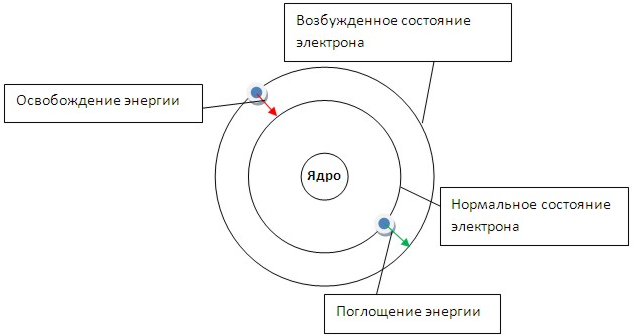
В 1913 г. Н. Бор внёс в планетарную модель атома квантовые представления. В основу своей теории Бор положил два постулата.
Первый постулат говорит о том, что электрон может вращаться вокруг ядра только по определенным стационарным орбитам. Находясь на них, он не излучает и не поглощает энергию. Второй постулат говорит о том, что при переходе с одной орбиты на другую электрон поглощает или выделяет квант (порцию) энергии.
 квантовая модель строения атома
квантовая модель строения атома
4. Строение атома. Атом состоит из ядра и электронов. Вся масса атома сосредоточена именно в ядре. Главной характеристикой атомного ядра, является то, что он имеет положительный заряд и состоит из протонов и нейтронов. Протоны заряжены положительно, а нейтроны не имеют заряда (они нейтральны). Связаны они друг с другом с помощью сильного ядерного взаимодействия. Электрон является отрицательно заряженной частицей. Электронная оболочка состоит из движущихся вокруг ядра электронов. Электроны имеют свойства притягиваться к ядру. Поверхность, охватывающая ядро атома, за пределами которой вероятность пребывания электрона исчезающе мала, называется граничной поверхностью электронного облака. Электронное облако и его граничную поверхность в атоме часто называют атомной орбиталью.
Заряд ядра -это порядковый номер элемента, которая определяет количество протонов и электронов в атоме.
Изотопы - атомы одного и того же элемента, содержащие в своих ядрах одинаковое число протонов, но различное число нейтронов. Изотопы имеют одинаковое строение электронных оболочек и занимают одно и то же место в периодической системе химических элементов.
Для названий и символов изотопов обычно используют названия и символы соответствующих химических элементов.
Верхний индекс указывает массовое число – сумму чисел протонов и нейтронов в ядре. Нижний индекс – порядковый номер элемента в периодической системе химических элементов. Например, водород имеет три изотопа:
· протий 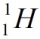
· дейтерий 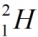
· тритий 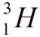 \
\
Расположение электронов по энергетическим уровням (тетрадь).
5. Пространство вокруг ядра, где вероятность нахождения электрона наиболее вероятна, называют электронной орбиталью, или электронным облаком. Это пространство имеет определенную форму, которая обозначается буквами s-, p-, d-, и f-.
Электронное облако s-электрона имеет сферическую форму; на s-энергетическом подуровне может максимально находиться два электрона.
Электронное облако p-электрона имеет гантелеобразную форму; на трёх p-орбиталях максимально может находиться шесть электронов. Формы d- и f-орбиталей значительно сложнее. Элементы главных подгрупп относятся к s- и p- элементам. Элементы побочных подгрупп относятся к d элементам. f элементы- это лантаноиды и актиноиды.
Вокруг ядра электроны расположены на электронных слоях. Каждый слой характеризуется расстоянием от ядра и энергией, поэтому электронные слои часто называют электронными энергетическими уровнями. Чем ближе уровень к ядру, тем меньше энергия электронов в нем. Один элемент отличается от другого числом протонов и электронов в ядре атома. Следовательно, число электронов в электронной оболочке нейтрального атома равно числу протонов, содержащихся в ядре этого атома. Каждый следующий элемент имеет в ядре на один протон больше, а в электронной оболочке – на один электрон больше.
6. Квантовые числа (тетрадь)
7. Окончательная формулировка Периодического закона – фундаментального закона природы была дана учёным Д. И. Менделеевым в июле 1871 г. Особенность Периодического закона среди других фундаментальных законов заключается в том, что он не выражен в виде математического уравнения и его графическим (табличным) выражением является разработанная Менделеевым Периодическая система элементов:
Элементы и их соединения находятся в периодической последовательности от заряда ядра атома.
Периоди́ческая систе́ма хими́ческих элеме́нтов (табли́ца Менделе́ева) — классификация химических элементов, устанавливающая зависимость различных свойств элементов от их заряда атомного ядра. Периоды – это ряды элементов, в которых свойства элементов меняются последовательно. Группы – это ряды элементов, обладающих сходными свойствами. В таблице Менделеева 8 групп. 1 гр.гл подгруппа- щелочные металлы; 2 гр.гл подгруппа- щелочноземельные металлы; 6 гр.гл подгруппа- халькогены; 7 гр.гл подгруппа- галогены; 8 гр.гл подгруппа- инертные газы. Семейство железа: Fe, Co, Ni; семейство платина: Ru, Rh, Pd, Os, Ir, Pt; Fr- самый типичный металл; F- самый типичный неметалл (тетрадь).
8.Характеристика элементов по положению в периодической системе Д.И.Менделеева (на примере серы). Возможные степени окисления.
(тетрадь)
9. Под химической связью понимается взаимное сцепление атомов в молекуле и кристаллической решетке, в результате действия силы притяжения, существующей между атомами. Именно благодаря химическим связям происходит образование различных химических соединений.
Ионная химическая связь – это связь, образовавшаяся между катионами и анионами за счет их электростатистического притяжения. Ионная связь образуется между металлом(I,II гр.) и неметаллом (VI,VII), при этом э.о. больше величины 1,7.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот поэтому ионная связь является ненасыщенной. «Молекулой» ионного соединения следует считать весь кристалл.
10. Химическая связь между атомами, возникающая путем обобществления электронов с образованием общих электронных пар, называется ковалентной. Ковалентная связь бывает полярной и неполярной. Ковалентная связь, образующаяся между атомами одного и того же элемента, называется неполярной. Ковалентная полярная связь образуется между элементами, э.о. которых меньше величины 1,7.
Образование общей электронной пары может происходить двумя способами.
1) При сближении двух атомов, имеющих неспаренные электроны, происходит взаимное проникновение соответствующих электронных орбиталей, их перекрывание. В месте перекрывания образуется так называемая электронная плотность, т.е. область пространства, где вероятность нахождения электрона значительно увеличивается. Область перекрывания условно считают общей электронной парой двух атомов. Такой механизм образования ковалентной связи называют обменным. 2) Второй способ образования ковалентной связи протекает по донорно-акцепторному механизму.
11. Металлическая связью называют связь в металлах и сплавах между
атом-ионами металлов, осуществляемую совокупностью валентных электронов.
Межмолекулярное взаимодействие — взаимодействие, не приводящее к разрыву или образованию новых химических связей.
Химическую связь между атомами водорода одной молекулы и атомами э.о.-ных элементов (фтором, кислородом, азотом) другой молекулы называют водородной. Водородную связь обозначают пунктиром. В органических соединениях может быть внутри. Водородная связь слабее, но она определяет такие физические св-ва как температура кипения, также пространственное строение. Засчет неё молекулы воды образуют ассоциаты, и вода имеет высокую температуру кипения.
Также между молекулами могут существовать и другие виды химических связей: ван-дер-вальсева, индукционная, ориентационная, дисперсная. (тетрадь)
Комплексообразование (тетрадь).
12. Кристаллические вещества характеризуются правильным расположением тех частиц, из которых они состоят, в строго определенных точках пространства. При соединении этих точек прямыми линиями образуется пространственный каркас, который называется кристаллической решеткой. Точки, в которых размещены частицы кристалла, называют узлами решетки.
Вещества с ионным типом связи имеют ионные кристаллические решетки. Такие соединения представляют собой твердые, прочные, нелетучие вещества с высокими температурами плавления. При обычных условиях кристаллы таких веществ не проводят электрический ток.
Кристаллические решетки, в узлах которых расположены атомы, называют атомными. Вещества с атомной кристаллической решеткой характеризуются большой прочностью и твердостью, высокой температурой плавления, они нелетучи, без химического взаимодействия не растворяются ни в каких растворителях.
Кристаллические решетки, в узлах которых расположены молекулы, называют молекулярными. Молекулярная решетка самая непрочная из всех типов решеток. Такие вещества имеют небольшую твердость, низкие температуры плавления, они летучи.
Металлическая связь определяет особое кристаллическое строение металлов и сплавов- металлическую кристаллическую решетку, в узлах которых расположены атомы-ионы. Эта решетка обусловливает характерные св-ва металлов: ковкость, пластичность, тягучесть, электро- и теплопроводность, металлический блеск, способность к образованию сплавов.
13. Основные классы неорганических и органических соединений.
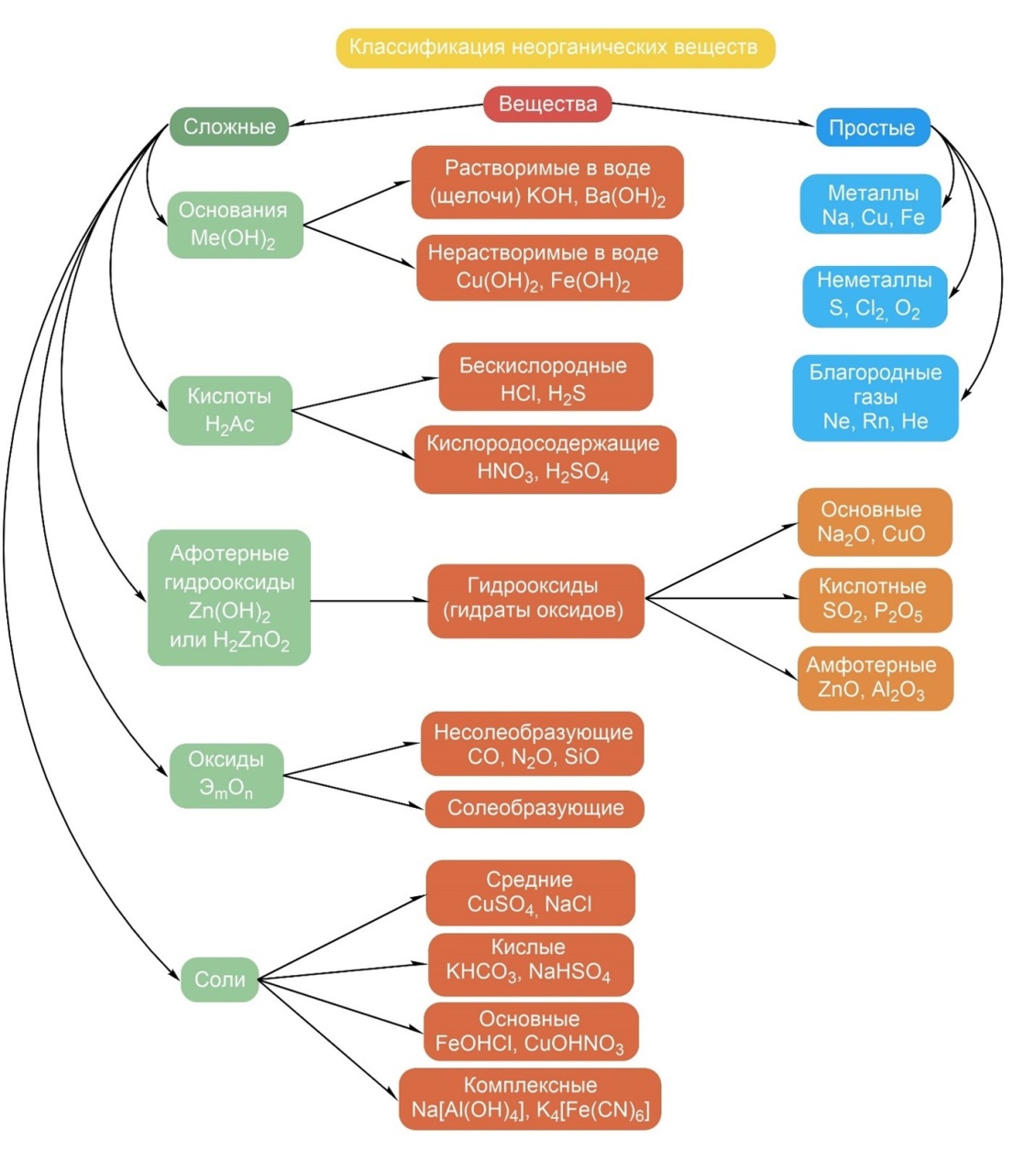
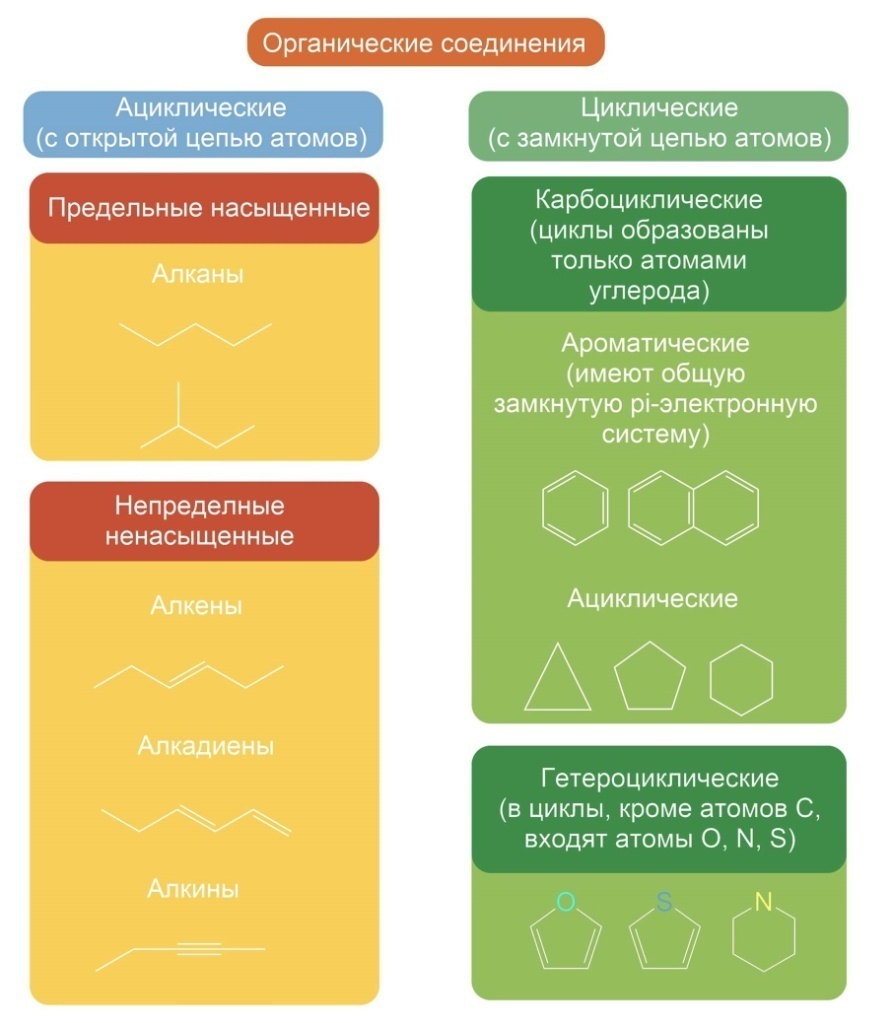
14. Дисперсные системы (истинные растворы, эмульсии, золи, коллоиды).(тетрадь)
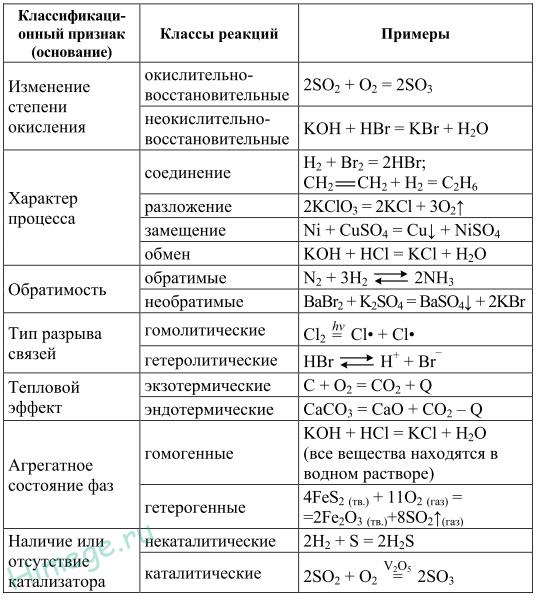
15. Классификация химических реакций в органической и неорганической химии.
| Реакции присоединения | В зависимости от того, какое соединение присоединяется органическим веществом различают: Гидрирование — присоединение водорода Гидратация — присоединение воды Гидрогалогенирование — присоединение галогеноводорода |
| Реакции замещения | Под реакциями замещения в органической химии подразумевают такие реакции, в результате протекания которых происходит замена одного заместителя (или атома водорода) непосредственно прикрепленного к углеродному скелету на другой заместитель. Так, например, реакциями замещения являются: Галогенирование алканов Нитрование углеводородов Реакция спиртов с галогеноводородными кислотами |
| Реакции отщепления (элиминирования) | дегидрирование дегидратация дегидрогалогенирование дегалогенирование: Также к реакциям отщепления (элиминирования) относят крекинг — процесс термического превращения углеводородов в соединения с меньшей длинной углеродного скелета. |
| Окислительно-восстановительные реакции | Реакции, при которых изменяется степень окисления одного или нескольких атомов углерода углеродного скелета. Окисление органического соединения(В таких реакциях отдельные атомы углерода повышают свою степень окисления.) Восстановление органического соединения Чаще всего под восстановлением органических веществ понимают их взаимодействие с водородом. Например: CH3-CH=O + H2 => CH3-CH2-OH |
| Реакции с сохранением качественного и количественного состава веществ | Изомеризация |
| Реакции протекающие по тем или иным механизмам | Реакции протекающие по ионному механизму В таких реакциях активными действующими частицами являются ионы. Следует помнить, что по ионному механизу протекают такие реакции как: · -гидратация алкенов и алкинов · -нитрование аренов азотной кислотой в присутствии концентрированной серной кислоты · -галогенирование аренов в присутствии катализатора (галогениды Al или Fe(III)) · -алкилирование аренов · -реакции спиртов с галогеноводородными кислотами · -реакции галогенпроизводных углеводородов с водным раствором щелочи · -присоединение галогенов по двойной или тройной связи |
| Реакции протекающие по радикальному механизму В таких реакциях активными действующими частицами являются свободные радикалы: · нитрование алканов · галогенирование алканов · присоединение хлора к бензолу при ультрафиолетовом облучении (с образованием гексахлорана — C6H6Cl6) |
16. Скорость химических реакций. Факторы, влияющие на скорость химических реакций.(тетрадь)
17. Все химические реакции можно разделить на необратимые и обратимые. Необратимыми называют химические реакции, в результате которых исходные вещества практически полностью превращаются в конечные продукты. К ним относятся реакции горения, большинство реакций, протекающих в растворах эликтролитов.
Обратимыми называют химические реакции, которые протекают одновременно в двух противоположных направлениях- прямом и обратном.
В обратимом химическом процессе в момент смешения исходных в-в скорость прямой реакции максимальная, т.к. максимальными являются концентрации реагентов. С течением времени исходные в-ва расходуются, превращаясь в продукты, их концентрация падает, следовательно, в соответствии с законом действующих масс уменьшается и скорость прямой реакции. Концентрация же продуктов увеличивается, а значит, скорость обратной реакции возрастает.
Состояние обратимого химического процесса, при котором скорости прямой и обратной реакции равны, называют химическим равновесием. Условия смещения химического равновесия.(тетрадь)
18.Растворы - это дисперсная система, состоящая из 2 и более компонентов. Дисперсионная среда- это жидкость, дисперсная фаза- и тв.в-ва, и ж.в-ва, и газы.
В настоящее время растворы рассматривают как физико-химические системы, занимающие по свойствам промежуточное положение между механическими смесями (физическими системами) и химическими соединениями.
В растворах, как в механических смесях, сохраняются химические свойства первоначально взятых веществ. Растворы и механические смеси не обладают постоянным составом, состав же химических соединений строго постоянен. Растворы – гомогенные системы, механические смеси – гетерогенны. Растворение как химическое взаимодействие сопровождается тепловыми эффектами, которые не наблюдаются при простом смешении.
По соотношению преобладания частиц, переходящих в раствор и удаляющихся из раствора, различают растворы насыщенные, ненасыщенные и перенасыщенные.
Насыщенный раствор - это раствор, который находится в равновесии с твердой фазой растворенного вещества и содержит максимально возможное при данных условиях количество этого вещества.
Раствор концентрация которого ниже концентрации насыщенного раствора называется ненасыщенным. В таком растворе можно при тех же условиях растворить дополнительное количество того же самого вещества.
Перенасыщенным называется раствор, в котором при данной температуре содержится большее количество растворенного вещества, чем возможно в насыщенном растворе.
По размерам дисперсной фазы растворы подразделяюся на: (тетрадь)Растворимость(тетрадь)
Способы выражения концентрации вещества в растворах
Массовая доля (или процентная концентрация вещества) – это отношение массы растворенного вещества m к общей массе раствора. Для бинарного раствора, состоящего из растворённого вещества и растворителя:
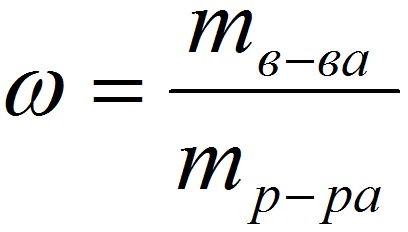
где:
ω – массовая доля растворенного вещества;
mв-ва – масса растворённого вещества;
mр-ра – масса растворителя.
Массовую долю выражают в долях от единицы или в процентах.
2. Молярная концентрация или молярность – это количество молей растворённого вещества в одном литре раствора V:
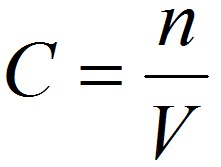
где:
C – молярная концентрация растворённого вещества, моль/л (возможно также обозначение М, например, 0,2 М HCl);
n – количество растворенного вещества, моль;
V – объём раствора, л.
Раствор называют молярным или одномолярным, если в 1 литре раствора растворено 1 моль вещества, децимолярным – растворено 0,1 моля вещества, сантимолярным – растворено 0,01 моля вещества, миллимолярным – растворено 0,001 моля вещества.
19. Экзотермическая реакция - химическая реакция, при которой происходит выделение теплоты. Например, в реакции горения метана
СН4(г)+ 2О2(г) = СО2(г) + 2Н2О(г)
выделяется столько теплоты, что метан используется как топливо.
Тот факт, что в этой реакции выделяется теплота, можно отразить в уравнении реакции:
СН4(г)+ 2О2(г) = СО2(г) + 2Н2О(г) + Q.
Это так называемое термохимическое уравнение. Здесь символ "+Q" означает, что при сжигании метана выделяется теплота. Эта теплота называется тепловым эффектом реакции.
Эндотермическая реакция- химическая реакция, при которой происходит поглощение теплоты.
Термохимическое уравнение реакции - уравнение реакции, включающее тепловой эффект реакции, рассчитанный на количества вещества, задаваемые коэффициентами этого уравнения
Тепловой эффект таких реакций отрицательный. Например:
CaCO3(кр)= CaO(кр) +CO2(г) - Q,
2HgO(кр)= 2Hg(ж) + O2(г) - Q,
2AgBr(кр)= 2Ag(кр) + Br2(г) – Q.
Количество теплоты, которое выделяется или поглощается врезультате реакций между определенными количествами реагентов, называют тепловым эффектом химическойреакции и обычно обозначают символом Q.
Она измеряется в кДж/моль. Согласно этому определению , теплота образования простого вещества при стандартныхусловиях равна 0.
20. Реакции ионного обмена — окислительно-восстановительная реакция, которая идет в направлении связывания ионов, но при которой не происходит изменения степеней окисления.
Условия течения реакций в растворах электролитов до конца(условия их необратимости):
1) в результате реакции выпадает осадок:
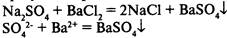
2) в результате реакции выделяется газ:
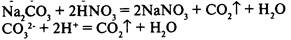
3) в результате реакции образуется малодиссоциирующее вещество:
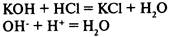
Полное ионное уравнение химической реакции: все соединения — электролиты, переписываем в ионном виде с учетом коэффициентов:
2NaOH + H2SO4 = Na2SO4 + 2H2O — молекулярное уравнение реакции
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O — полное ионное уравнение реакции
Сокращенное ионное уравнение химической реакции: сокращаем одинаковые составляющие:
2Na+ +2OH— +2H+ + SO-2 = 2Na+ + SO4-2 + 2H2O
OH— + H+ = H2O — сокращенное ионное уравнение реакции
|
из
5.00
|
Обсуждение в статье: Способы выражения концентрации вещества в растворах |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

