 |
Главная |
Электролитические реакции.
|
из
5.00
|
Все рассмотренные выше примеры замыкания цикла представляют собой внутримолекулярные версии хорошо известных реакций образования σ-связей. Электроциклические реакции существенно отличаются от этих примеров прежде всего тем, что не имеют межмолекулярных аналогов. Ациклические реагенты, используемые при электроциклическом замыкании цикла, должны представлять собой полностью сопряженные π-электронные системы. В электроциклических реакциях образование σ-связи происходит в результате преобразования π-системы. Нормальное течение процесса достигается при нагревании или облучении без участия дополнительных реагентов. Электроциклические процессы равновесны, причем равновесие обычно смещено в сторону ациклических изомеров, поэтому такие реакции более применимы для раскрытия, а не для замыкания цикла.
 Четыре типа электроциклических реакций, применяемых при синтезе гетероциклических соединений, схематически показаны на рис. 10. Примеры (а) и (б) иллюстрируют превращения сопряженных систем, содержащих четыре π-электрона. Замыкание цикла происходит либо в 1,3-диполе (а), либо в гетеродиене (б). Реакции (в) и (г) аналогичны (а) и (б), но цикл замыкается в шестиэлектронной π-системе. Таким образом, сопряженные π-электронные ациклические молекулы могут быть предшественниками насыщенных или частично насыщенных гетероциклов, содержащих от трех до шести атомов в цикле. Возможны также электроциклические процессы в сопряженных π-системах с числом электронов больше шести, хотя встречаются они гораздо реже.
Четыре типа электроциклических реакций, применяемых при синтезе гетероциклических соединений, схематически показаны на рис. 10. Примеры (а) и (б) иллюстрируют превращения сопряженных систем, содержащих четыре π-электрона. Замыкание цикла происходит либо в 1,3-диполе (а), либо в гетеродиене (б). Реакции (в) и (г) аналогичны (а) и (б), но цикл замыкается в шестиэлектронной π-системе. Таким образом, сопряженные π-электронные ациклические молекулы могут быть предшественниками насыщенных или частично насыщенных гетероциклов, содержащих от трех до шести атомов в цикле. Возможны также электроциклические процессы в сопряженных π-системах с числом электронов больше шести, хотя встречаются они гораздо реже.
Объяснение стереохимии реакций электроциклического замыкания и раскрытия циклов – первое достижение теории сохранения орбитальной симметрии, разработанной Вудвардом и Гофманом. Различают два типа электроциклизаций. В первом вращение р-орбиталей π-электронной системы осуществляется в одном направлении и приводит к образованию новой σ-связи, во втором – вращение происходит в разных направлениях. Первый процесс называют конротаторным (рис. 11, а), второй – дисротаторным (рис. 11, б). Правила Вудварда – Гофмана позволяют определить, какой из типов замыкания цикла предпочтителен, и тем самым предсказывают стереохимию образующегося циклического соединения. Правила определяются числом π-электронов, образующих сопряженную ациклическую систему, и тем, протекает ли процесс в основном состоянии (термическая реакция) или в первом возбужденном состоянии (фотохимическая реакция) полиена. Иллюстрация правил Вудварда – Гофмана приведена на рис. 11.
Любую электроциклическую реакцию можно осуществить как при нагревании (термически), так и при облучении (фотохимически), однако стереохимический результат в этих двух случаях будет различным. Синтетическая значимость электроциклических реакций существенно зависит от положения равновесия, поскольку это определяет, может ли циклический изомер быть выделен с удовлетворительным выходом из реакционной смеси. Положение этого равновесия может быть различным для термических и фотохимических процессов. Стереохимические различия между конротаторными и дисротаторными процессами исчезают в том случае, когда терминальное положение ациклической π-системы занимает гетероатом. Так, для большинства электроциклических процессов, приводящих к образованию гетероциклических соединений, правила Вудварда – Гофмана не имеют смысла.
Шестиэлектронные электроциклические процессы типа (в) (рис. 10) – 1,5-биполярное замыкание цикла – более распространены. В этом случае также наблюдаются равновесные процессы замыкания и раскрытия цикла. Нестабильные 1,5-диполи обычно получают in situ и при нагревании превращают в пятичленные гетероциклы. Циклический изомер может быть выведен из равновесия при таутомерном превращении в более стабильное (часто ароматическое) соединение. Примеры 1,5-диполярного замыкания цикла приведены в табл. 5. Пример 1 демонстрирует замыкание цикла в нестабильном 1,5-диполе. В примерах 2 и 3 первоначально образующийся продукт циклизации тау-томеризуется в ароматическое соединение, что смещает равновесие в сторону циклического изомера. Реакции 4 и 5 сразу приводят к образованию ароматических гетероциклов.
Таблица 5. Примеры 1,5-диполярной циклизации.
| Исходное соединение | 1,5-диполярный интермедиат | Продукт циклизации | Конечный продукт (если он отличается) |
| 1. |
|
| _____ |
| 2. Винилдиазометан не может быть выделен, но циклизуется при t>250C. |
|
|
|
| 3. |
|
|
|
| 4. |
|
| _____ |
| 5. |
|
| _____ |
Электроциклические процессы в гетеротриенах [реакция (г), рис. 11)] могут быть применены при синтезе некоторых шестичленных гетероциклов, особенно в тех случаях, когда продукт циклизации способен к ароматизации. Для шестиэлектронных электроциклических процессов, так же как и в других случаях, возможна обратная реакция раскрытия цикла. В некоторых случаях этот обратный процесс более важен с синтетической точки зрения.
В табл. 6 приведены некоторые примеры синтеза шестичленных гетероциклов с использованием электроциклических процессов Синтез изохинолинов (реакция 4) основан на двух электроциклических реакциях: образовании орто-ксилиленового интермедиата при раскрытии бензоциклобутана и 6π-электронном электроциклическом процессе. Замыкание цикла на второй стадии идет очень легко, так как при этом восстанавливается ароматичность бензольного кольца.
В некоторых случаях электроциклические процессы в гетеротриенах приводят к образованию пятичленных гетероциклов. Вероятность протекания таких процессов увеличивается при наличии электроотрицательного гетероатома в терминальном положении гетеродиена.
Таблица 6. Образование шестичленных гетероциклов электроциклизацией.
| Исходное соединение | Интермедиат | Продукт реакции |
| 1. | _______ |
|
| 2. |
|
|
| 3. |
|
|
| 4. |
|
|
| 5. |
|
|
Акридин.
Общие сведения. Акридин является дибензопиридином и относится к хинолину так же, как антрацен к нафталину. Его можно рассматривать как антрацен, в котором одна центральная группа =СН- замещена азотом.
Нумерация атомов производится следующим образом:
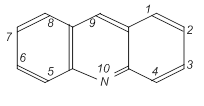

I II
В ряде стран, в том числе в России, принята нумерация I, в других странах (Англия, США) – нумерация II.
Акридин открыт в 1870г. в неочищенной антраценовой фракции каменно-угольного дегтя. Он плавится при 107οС, кипит при 345-346οС, легко возгоняется. Обладает характерным запахом, вызывает раздражение дыхательных путей, раздражает кожу, откуда и произошло название (acer – едкий). Акридин светится при трении (триболюминисценция). Разбавленные растворы имеют синюю флуоресценцию. Соли акридина в разбавленных растворах обладают зеленой флуоресценцией. При дальнейшем разбавлении, вызывающем гидролиз, флуоресценция переходит в синюю, характерную для свободного акридина. Акридиновое ядро составляет основу некоторых алкалоидов. Многие синтетические производные акридина являются ценными лекарственными препаратами и красителями.
Способы получения. Несмотря на то, что акридин содержится в каменноугольной смоле, его производные и сам акридин получают синтетически из производных бензола.
1. Наиболее общим способом получения акридина является циклизация о-анилинобензойной кислоты. Замыкание цикла может быть достигнуто с помощью серной кислоты, и в этом случае образуется акридон. Он может быть восстановлен амальгамой натрия в дигидроакридин (акридан), который затем окисляют хлоридом железа в акридин (рис. 12).
Однако чаще всего циклизацию проводят с помощью РОСl3 получая 9-хлоракридин (рис. 13).
Хлор, находящийся в мезо-положении, отличается большой реакционной способностью и легко может быть замещен алкокси-, аминогруппой или водородом. Используя замещенные о-анилинобензойные кислоты, можно получить различные производные акридина.
2. Конденсация м-фенилендиамина с муравьиной кислотой или формальдегидом позволяет получать 3- и 6-диаминоакридины:
Химические свойства. Акридин является слабым основанием, образует соли, такие, как хлорид, нитрат, пикрат и т.п., окрашенные четвертичные аммониевые соли (соединения акридиния) и N-оксид (при обработке гидропероксидом бензоила).
Акридин кипит при высокой температуре без разложения и не изменяется при сплавлении с едким кали. Окисление перманганатом частично разрушает молекулу с образованием акридиновой кислоты (2,3-хинолиндикарбоновая кислота) (рис. 14, I), однако дихромат в уксусной кислоте не разрушает циклическую структуру акридина, но превращает его в акридон (рис. 14, II) и 10,10'-диакридоннл (рис. 14, III).
Между акридином и антраценом имеется сходство. Оно выражается в способности акридина к восстановлению водородом в момент выделения (при действии натрия в водных и спиртовых растворах или при каталитическом гидрировании в 9,10-дигидроакридин. Присоединение натрия с образованием 9,10-динатриевого производного, которое со спиртом дает акридан, напоминает реакцию натрия с антраценом.
Некоторые реакции акридина напоминают реакции пиридина и его производных. Литий-алкилы присоединяются к акридину в положения 9, 10, т.е. по концам сопряженной системы. Последующий гидролиз дает производное 9,10-дигидроакридина.
Мезо-метилакридин, подобно 4-пиколину, конденсируется с альдегидами.
Производные акридина. Из производных акридина важное применение имел так называемый акрихин – 6-хлор-2-метокси-9-(1-метил-4-диэтиламино) бутиламиноакридин дихлоргидрат – желтое кристаллическое вещество с т. пл. 248—250 °С.
Акрихин широко использовался для предупреждения и лечения малярии. Он в известной степени является заменителем хинина.
Риванол — соль молочной кислоты акридинового производного следующего строения:
Эффективный антисептик. Применяется также для лечения амебной
дизентерии.
|
из
5.00
|
Обсуждение в статье: Электролитические реакции. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы


 , нагревание
, нагревание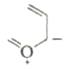











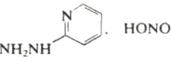
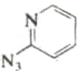

 , нагревание
, нагревание
 , нагревание
, нагревание



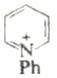
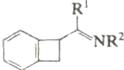 , нагревание
, нагревание



