 |
Главная |
Механизм буферного действия (на примере аммиачного буфера)
|
из
5.00
|
Механизм действия буферной системы рассмотрим на примере аммиачной буферной системы: NН4ОН (NН3 х Н2О) + NН4С1.
Гидроксид аммония - слабый электролит, в растворе частично диссоциирует на ионы:
NН4ОН <=> NН4+ + ОН-
При добавлении к раствору гидроксида аммония хлорида аммония, соль как сильный электролит практически полностью диссоциирует на ионы NН4С1 → NН4+ + С1- и подавляет диссоциацию основания, равновесие которого смещается в сторону обратной реакции. Поэтому С (NН4ОН) ≈ С (основания); а С (NН4+) ≈ С (соли).
Если в буферном растворе С (NН4ОН) = С (NН4С1), то рН = 14 - рКосн. = 14 + lg 1,8.10-5 = 9,25.
Способность буферных смесей поддерживать практически постоянное значение рН раствора основана на том, что входящие в них компоненты связывают ионы Н+ и ОН-, вводимые в раствор или образующиеся в результате реакции, протекающей в этом растворе. При добавлении к аммиачной буферной смеси сильной кислоты, ионы Н+ будут связываться молекулами аммиака или гидроксида аммония, а не увеличивать концентрацию ионов Н+ и уменьшать рН раствора.
При добавлении щелочи ионы ОН - будут связывать ионы NН4 +, образуя при этом малодиссоциированное соединение, а не увеличивать рН раствора.
Буферное действие прекращается, как только одна из составных частей буферного раствора (сопряженное основание или сопряженная кислота) полностью израсходуется.
Для количественной характеристики способности буферного раствора противостоять влиянию сильных кислот и оснований используется величина, называемая буферной емкостью. По мере увеличения концентрации буферного раствора возрастает его способность сопротивляться изменению рН при добавлении кислот или щелочей.
Свойство растворов сохранять значение рН в определенных пределах при добавлении небольших количеств кислоты или щелочи называется буферным действием. Растворы, обладающие буферным действием, называются буферными смесями.
Для случая титрования: щавелевая кислота и гидроксид калия, изобразите кривую титрования, укажите случай титрования, скачок титрования, точку эквивалентности, используемые индикаторы
|
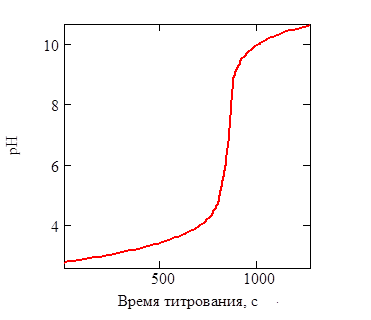
Скачок титрования: pH = 4-10. Максимальная ошибка в% - меньше 0.4.
Индикаторы - тимолфталеин, фенолфталеин.
Восстановитель, какие элементы периодической системы элементов могут быть восстановителями и почему?
Восстановитель - это вещество, которое в ходе реакции отдает электроны, т.е. окисляется.
Восстановителями могут быть нейтральные атомы, отрицательно заряженные ионы неметаллов, положительно заряженные ионы металлов в низшей степени окисления, сложные ионы и молекулы, содержащие атомы в состоянии промежуточной степени окисления.
Нейтральные атомы. Типичными восстановителями являются атомы, на внешнем энергетическом уровне которых имеется от 1 до 3 электронов. К этой группе восстановителей относятся металлы, т.е. s-, d - и f-элементы. Восстановительные свойства проявляют и неметаллы, например водород и углерод. В химических реакциях они отдают электроны.
Сильными восстановителями являются атомы с малым потенциалом ионизации. К ним относятся атомы элементов двух первых главных подгрупп периодической системы элементов Д.И. Менделеева (щелочные и щелочноземельные металлы), а также Аl, Fe и др.
В главных подгруппах периодической системы восстановительная способность нейтральных атомов растет с увеличением радиуса атомов. Так, например, в ряду Li - Fr более слабым восстановителем будет Li, а сильным - Fr, который вообще является самым сильным восстановителем из всех элементов периодической системы.
Отрицательно заряженные ионы неметаллов. Отрицательно заряженные ионы образуются присоединением к нейтральному атому неметалла одного или несколько электронов:
Так, например, нейтральные атомы серы, йода, имеющие на внешних уровнях 6 и 7 электронов, могут присоединить соответственно 2 и 1 электрон и превратиться в отрицательно заряженные ионы.
Отрицательно заряженные ионы являются сильными восстановителями, так как они могут при соответствующих условиях отдавать не только слабо удерживаемые избыточные электроны, но и электроны со своего внешнего уровня. При этом, чем более активен неметалл как окислитель, тем слабее его восстановительная способность в состоянии отрицательного иона. И наоборот, чем менее активен неметалл как окислитель, тем активнее он в состоянии отрицательного иона как восстановитель.
Восстановительная способность отрицательно заряженных ионов при одинаковой величине заряда растет с увеличением радиуса атома. Поэтому, например, в группе галогенов ион йода обладает большей восстановительной способностью, чем ионы брома и хлора, a фтор - восстановительных свойств совсем не проявляет.
Положительно заряженные ионы металлов в низшей степени окисления. Ионы металлов в низшей степени окисления образуются из нейтральных атомов в результате отдачи только части электронов с внешней оболочки. Так, например, атомы олова, хрома, железа, меди и церия, вступая во взаимодействие с другими веществами, вначале могут отдать минимальное число электронов.
Ионы металлов в низшей степени окисления могут проявлять восстановительные свойства, если у них возможны состояния с более высокой степенью окисления.
В уравнении ОВР расставьте коэффициенты методом электронного баланса. Укажите окислитель и восстановитель.
K2Cr2O7 + 6FeSO4 + 7H2SO4 = K2SO4 + Cr2 (SO4) 3 + 3Fe2 (SO4) 3 + 7H2O
1 Cr2+6 +3е x 2 Cr2+3 окислитель
6 Fe +2 - 1е Fe+3 восстановитель
2KMnO4 + 5H2S + 3H2SO4 = K2SO4 + 2MnSO4 + 5S + 8H2O
2 Mn+7 + 5е Mn+2 окислитель
5 S-2 - 2е S0 восстановитель
|
из
5.00
|
Обсуждение в статье: Механизм буферного действия (на примере аммиачного буфера) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

