 |
Главная |
Железо и его соединения
|
из
5.00
|
Железо встречается в природе в виде минералов: Fe3O4 - магнитный железняк, Fe2O3 - красный железняк, Fe2O3·H2O - бурый железняк, FeS2 - пирит.
Получение: Восстановлением оксидов при высокой температуре с помощью окиси углерода, кокса, водорода:
3Fe2O3 + CO = 2Fe3O4 + CO2,
Fe3O4 + CO = 3FeO + CO2,
FeO + C = Fe + CO,
Fe2O3 + 3H2 = 2Fe + 3H2O.
Свойства: Для железа наиболее характерной степенью окисления является +3, возможна и +2, мало встречается +6. В ряду активностей металлов железо стоит левее водорода и вытесняет его из кислот:
Fe + 2HCl = FeCl2 + H2.
При нагревании железо растворяется в кислотах - сильных окислителях. При высокой температуре (8000 С) железо разлагает воду (промышленный способ получения водорода): 3Fe + 4H2O = Fe3O4 + 4H2 .
Железо реагирует с активными неметаллами:
2Fe + 3Cl2 = 2FeCl3,
Fe + S = FeS.
На воздухе в присутствии паров воды и углекислого газа происходит ржавление железа:
Fe + 1/2 O2 + H2O + 2 CO2 = Fe(HCO3)2,
Fe(HCO3)2 + 2 H2O = Fe(OH)2 + 2H2O + 2CO2,
2Fe(OH)2 + 1/2 O2 + H2O = 2Fe(OH)3.
Железо вытесняет менее активные металлы из растворов их солей:
CuCl2 + Fe = FeCl2 + Cu¯ .
Кислородные соединения железа
Некоторые способы получения оксидов:
FeC2O4  FeO + CO2 + CO
FeO + CO2 + CO
3Fe + O2 = Fe3O4
2Fe(OH)3  Fe2O3 + 3H2O
Fe2O3 + 3H2O
Оксиды FeO и Fe2O3 не растворяются в воде, но растворяются в кислотах:
FeO + 2HCl = FeCl2 + H2O,
Fe2O3 + 6HCl = 2FeCl3 + 3H2O.
Отвечающие оксидам железа гидроксиды получают, действуя щелочами на соли железа:
| FeCl2 + 2NaOH = | Fe(OH)2¯ + 2NaCl |
| белый |
| FeCl3 + 3NaOH = | Fe(OH)3¯ + 3NaCl |
| коричневый |
FeCl3 + 3NaHCO3 = Fe(OH)3 + 3CO2 + 3NaCl
Соли двухвалентного железа легко окисляются кислородом воздуха
4FeSO4 + 2H2O + O2 = 4Fe(OH)SO4,
и другими окислителями:
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
Получение и свойства карбонатов железа:
FeCl2 + 2NaHCO3 = FeCO3 + H2O + CO2+ 2NaCl FeCO3 + H2O + CO2 = Fe(HCO3)2,
FeS + 2HCl = FeCl2 + H2S.
При сильном нагревании соли разлагаются:
Fe2(SO4)3 ® Fe2O3 + 3SO3.
Соли железа (III) реагируют с сильными восстановителями:
2FeCl3 + 2KI = 2FeCl2 + 2KCl + I2 2FeCl3 + 3Na2S = 2FeS + S + 2KCl + 6NaCl
Качественные реакции на ионы Fe2+ и Fe3+:
FeCl3 + 3KSCN = Fe(SCN)3 + 3KCl
(вишневый цвет раствора)
Комплексные соединения железа:
| Fe(CN)2 + 4KCN = | K4[Fe(CN)6] |
| гексоцианоферрат (II) калия | |
| желтая кровяная соль | |
| Fe(CN)3 + 3KCN = | K3[Fe(CN)6] |
| гексоцианоферрат (III) калия | |
| красная кровяная соль |
Эти соли являются реактивами на Fe2+ и Fe3+:
| 3K4[Fe(CN)6] + 4FeCl3 = | Fe4[Fe(CN)6]3¯ + 12KCl |
| берлинская лазурь | |
| 2K3[Fe(CN)6] + 3FeCl2 = | Fe3[Fe(CN)6]2¯ + 6KCl |
| турнбулева синь |
Применение: Широко используются в промышленности сплавы железа с углеродом (стали, чугуны). На основе Fe2O3 получаются ферриты, важнейшие магнитные материалы для современной техники. Железо используется как катализатор во многих химических производствах. Оно входит в состав ферментов, катализирующих различные биохимические реакции.
Цинк и его соединения
Цинк - серебристо-серый металл, встречается в природе только в связанном состоянии: ZnS - цинковая обманка, ZnCO3 - цинковый шпат.
Получение. Цинк можно получить по реакциям:
2ZnS + 3O2 = 2ZnO + 2SO2,
ZnCO3 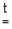 ZnO + CO2,
ZnO + CO2,
ZnO +C 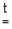 Zn + CO,
Zn + CO,
ZnO + CO 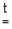 Zn + CO2,
Zn + CO2,
ZnO + H2SO4 = ZnSO4 + H2O,
электролизом ZnSO4.
Свойства
Для цинка характерна только одна степень окисления +2. Цинк растворяется как в кислотах, так и в щелочах, вытесняя водород:
Zn + 2 HCl = ZnCl2 + H2,
Реакция цинка с соляной кислотой ускорятся в присутствии солей меди и замедляется в присутствии солей ртути:
Zn + 2NaOH +2H2O = Na2[Zn(OH)4] + H2.
Цинк растворяется в кислотах - сильных окислителях:
4Zn + 10HNO3(разб) =
= 4Zn(NO3)2 + 3H2O + NH4NO3,
Zn + 4HNO3(конц) = Zn(NO3)2 + 2H2O + 2NO2 ,
Zn + 2H2SO4(конц) = ZnSO4 + 2H2O + SO2 .
|
из
5.00
|
Обсуждение в статье: Железо и его соединения |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

