 |
Главная |
Атомный номер элемента. изотопы
|
из
5.00
|
Строение атома
Ядро и электроны
Развитие естествознания на границе XIX-XX веков показало, что помимо химических превращений существует целый ряд процессов, в которых атомы выступают как сложные объекты, состоящие из положительно заряженной части - ядра и отрицательно заряженных электронов, суммарный заряд которых в точности компенсирует заряд ядра. В результате работ английского физика Дж. Дж. Томсона и американского физика Р.С. Малликена было установлено, что электрон имеет массу 9,1•1031 кг, или 1/1837 массы атома водорода, и заряд 1,6•10 19 Кл. Основная масса атома сосредоточена в ядре, которое занимает очень малую часть его объема: диаметр ядра порядка 1СГ14 м, он составляет лишь около 10 4 диаметра атома. Наглядно это соотношение размеров можно представить себе, если увеличить атом в 1011 раз: тогда ядро диаметром 1 мм разместится внутри атома диаметром 10 метров!
Позднее было показано, что атомные ядра состоят из положительно заряженных частиц - протонов и незаряженных частиц - нейтронов. Протон имеет заряд, равный заряду электрона, но со знаком плюс, его масса практически равна массе нейтрона. Отметим, что в химии принято выражать заряды ионов в единицах заряда электрона с соответствующим знаком, например Н+, Mg2+, СГ.
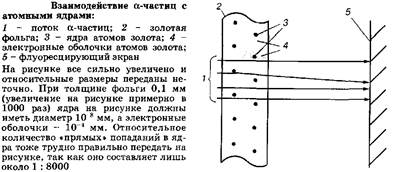
Таким образом, число протонов в ядре определяет его заряд и порядковый номер, а сумма чисел протонов и нейтронов - округленную общую массу ядра в атомных единицах, или массовое число атома. Очевидно, что в электронейтральном атоме число протонов в атомном ядре равно числу электронов в электронной оболочке атома.
Атомный номер элемента. изотопы
Порядковый номер элемента принято называть его атомным номером и обозначать буквой Z. Атомный номер лежит в основе систематизации химических элементов и определяет их положение в периодической системе.
При определенном атомном номере, т.е. при определенном числе протонов, в ядре могут находиться разные числа нейтронов, поэтому могут существовать отличающиеся по массе разновидности атомов одного и того же элемента - изотопы.
Например, природный водород представляет собой смесь изотопов с массовыми числами 1 и 2, а.
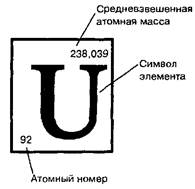
Клетка периодической таблицы
В ядре атома урана 92 протона, а в его электронной оболочке - 92 электрона
В периодической таблице, элементы расположены в порядке увеличения заряда ядра, а в отдельных клеточках таблицы принято приводить средневзвешенные атомные массы, поэтому они часто сильно отличаются от целочисленных.

Рис. 2.3, а. Масс-спектрометр.
Газ вводится в вакуумированный прибор через трубку (i) и подвергается ионизации потоком электронов из электронной пушки (2). Заряженные пластины (3) и (4) разгоняют поток полученных положительных ионов, который проходит через щель в пластине (4) и попадает в поле магнита (5), отклоняющее отдельные ионы в соответствии с отношением заряд: масса. За второй щелью (в) расположен детектор (7), который регистрирует число частиц, прошедших через щель. Меняя напряженность магнитного поля, можно последовательно регистрировать относительное количество ионов с различной массой, получая масс-спектр.
В масс-спектрометре молекулы газа превращаются в ионы. Показана часть масс-спектра, соответствующая нонам ТЮ+ и ТЮ2. Отдельные полосы отвечают пяти изотопам титана с массой 46, 47, 48, 49, 50 значений масс атомов и разделение изотопов стало возможным в результате создания масс-спектрометрии - метода, основанного на воздействии магнитного поля на направленные пучки заряженных частиц.
Ядерная модель атома
Первая модель атома была предложена в начале XX века Э. Резерфордом, новозеландцем, работавшем в Англии. Она предполагала, что электроны движутся с большой скоростью по круговым орбитам вокруг ядра, подобно планетам по отношению к Солнцу. По представлениям классической электромагнитной теории в таком атоме электрон должен приближаться по спирали к ядру, непрерывно излучая энергию. Через короткое время электрон неизбежно должен упасть на ядро. Это очевидное несоответствие фактам было не единственным недостатком модели Резерфорда: плавное изменение энергии электронов в атоме не согласовывалось с появившимися наблюдениями над спектрами атомов. Одним из достижений второй половины XIX века была разработка атомного спектрального анализа - точного и чувствительного метода, сыгравшего важнейшую роль в открытии новых элементов и послужившего экспериментальной основой изучения строения атомов. Метод основан на испускании света свободными атомами, получающимися при сильном нагреваний вещества; при этом атомы переходят из основного состояния с минимальной энергией в возбужденные состояния с более высокими энергиями.
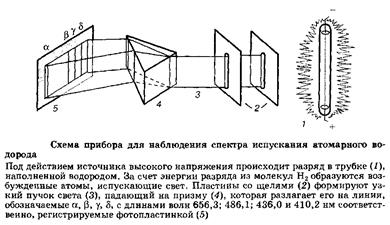
Возвращаясь в основное состояние, атомы излучают свет. Оказалось, что атомные спектры излучения состоят из отдельных линий, отвечающих только определенным длинам волн.
Чтобы объяснить линейчатый характер атомных спектров и устойчивость атомов, знаменитый датский физик Нильс Бор предложил два постулата, выходящие за рамки классической физики:
Из бесконечного числа орбит, возможных с точки зрения классической механики, допустимы лишь определенные орбиты, по которым электрон движется не излучая.
Частота поглощаемого или испускаемого атомом излучения при переходе из одного разрешенного состояния в другое определяется разностью энергий этих состояний.
При этом Бор опирался на идею Макса Планка о квантовании энергии. Планк установил, что, хотя свет, испускаемый раскаленным телом, кажется сплошным, световая энергия поглощается или излучается отдельными порциями - квантами Е = hv, пропорциональными частоте светового электромагнитного колебания. Коэффициент пропорциональности h = 6,6252 • 10 34 Дж • с был назван постоянной Планка. Таким образом в науку было введено понятие кванта света, или некоторого светового пакета - фотона, отражающее не только волновую, но и корпускулярную природу света.
Модель Бора позволила рассчитать точные значения энергии атома водорода и любых одноэлектронных ионов, но оказалась непригодной для объяснения наблюдаемых энергетических характеристик атомов с двумя и более электронами; главный же ее недостаток заключался в том, что она не давала логического обоснования природы квантования и устойчивости не меняющихся во времени состояний атома. Однако, несмотря на эти недостатки, сами идеи Бора о квантовании и стационарных состояниях легли в основу современного описания строения атома с позиций квантовой механики.
|
из
5.00
|
Обсуждение в статье: Атомный номер элемента. изотопы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

