 |
Главная |
Правила множественных вычислений
|
из
5.00
|
Формулируя правила множественных вычислений, мы исходим из того, что точность ответа не может быть выше точности данных, указанных в условии. Это означает, что в полученном числе должно быть столько верных цифр, сколько их в наименее точном исходном числе.
Если в процессе решения задачи определены все числа, то предварительно, перед выполнением действий, числа можно округлить, руководствуясь следующим правилом.
• Чтобы получить ответ с и верными цифрами в наименее точном числе, необходимо все остальные числовые значения задать с п + 2 верными цифрами. Результаты промежуточных вычислений также должны иметь п + 2 верных цифр.
Если необходимо или возможно объединить несколько арифметических действий в одно, применяется следующее правило.
• Вычисления следует производить последовательно, так как правила вычислений приближённых чисел различны для разных арифметических действий. Можно объединить несколько последовательных действий в одно выражение, если они представляют сложение нескольких чисел, умножение и деление нескольких чисел. В задаче 1 мы столкнулись с необходимостью произвести умножение и вычитание. В соответствии с правилами эти действия следует выполнять последовательно.
Рассмотрим оба способа, чтобы сравнить ответы.
Способ 1. Масса смеси 26,3 г — три значащие цифры, массовая доля примесей 0,026, — две значащие цифры. Согласно правилам умножения оба числа остаются без изменения, умножаем, в ответе оставляем две значащие цифры:
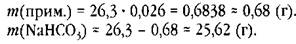
После округления:
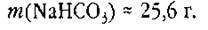
Способ 2
w(NaHC03) = 1,000 - 0,026 = 0,974. (Так как 1 — точное число.)
Числа 26,3 и 0,974 имеют одинаковое число значащих цифр, мы их не округляем и находим произведение:
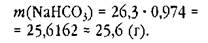
Ответы совпали, но в другом примере они могут и не совпасть.
Теперь определим молярные массы гидрокарбоната натрия и хлороводорода. Их можно найти в справочнике: iW(NaHC03) = = 84,01 г/моль, Jlf(HCl) = 36,46 г/моль. Но традиционно вычисляют суммы молярных масс атомов элементов, составляющих формульную единицу вещества, округляя их до целых, за исключением хлора, относительную атомную массу которого округляют до 35,5 (безо всяких на то оснований). Следует иметь в виду, что при вычислении молярной массы вещества округлять её значение необходимо в соответствии с правилами округления, а именно до наименее точного числа, а не до целых, как обычно.
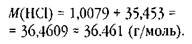
Так как в числе 1,0079 на один десятичный знак больше, чем в менее точном числе 35,453, то ни одно число не округляют.
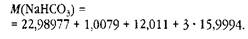
По правилам в одном выражении нельзя складывать и умножать, поэтому сначала найдём молярную массу кислорода в питьевой соде как произведение, а потом молярную массу питьевой соды как сумму:
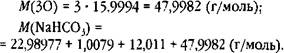
Поскольку наименее точное число 12,011, округлим все остальные числа до четырёх десятичных знаков: 22,9898; 1,0079 и 47,9982. Сумму четырёх слагаемых округлим до трёх десятичных знаков:
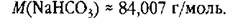
Теперь рассчитаем массу хлороводорода, реагирующего с заданной массой питьевой соды. Такие задачи решают, как правило, составлением пропорции:
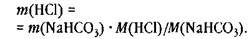
Это выражение включает умножение и деление, вычислять в два действия не требуется.
Сначала подставим молярные массы, взятые из справочника:
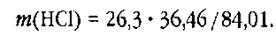
Так как наиболее точное число имеет всего на одну значащую и верную цифру больше, чем наименее точное, то все числа остаются без округления. Считаем на двенадцатиразрядном калькуляторе. После округления полученного числа до числа значащих цифр в наименее точном сомножителе (три) получаем окончательный ответ:
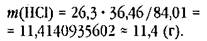
Вычислим массу хлороводорода, используя рассчитанные молярные массы:
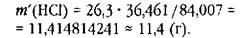
При вычислении массы традиционным способом наименее точное число имеет две значащие цифры:
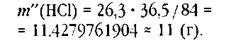
• Мы считаем, что молярные массы веществ лучше брать из справочника. При вычислении необходимо оставлять максимальное число верных десятичных знаков.
Далее определим массу соляной кислоты.
Массовая доля хлороводорода в задаче 1 задана в процентах. Но массовую долю вещества в растворе можно выразить в разных относительных единицах, допускаемых СИ (международной системой единиц) и имеющих соответствующие обозначения: процентах — %, промилле — %о (миллионных долей — млн'1). Только относительная единица — доля единицы (0,1, 0,125, 1/2 и т. д.) не имеет обозначения. При записи это приводит к путанице.
Если записать, что и>(в-ва) = 0,10 = 10%, то запись будет верной. Поскольку из контекста ясно, что 0,10 — это не просто число и не числовое значение величины массовой доли, а значение этой величины. Запись «10%» означает, что число 10 умножено на значение единицы измерения относительной величины, обозначаемой знаком «%» (1/100), что эквивалентно записи «10 • 1/100». Если же записать просто «0,1», то в этой записи нет контекста, из которого следует, что 0,1 — это значение относительной величины, а не просто число.
Чтобы этой путаницы не происходило, учителя придумали запись, которой традиционно пользуются. Например, для определения массы раствора записывают следующее уравнение:
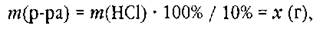
хотя корректно эта запись должна выглядеть так:
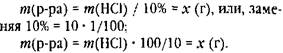
Но тогда возникает вопрос, откуда взялось число 100.
Итак, необходимо рассмотреть, как переводить одни единицы физических величин в другие.
|
из
5.00
|
Обсуждение в статье: Правила множественных вычислений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

