 |
Главная |
Серологические методы диагностики и мониторинга дифтерийной инфекции
|
из
5.00
|
Федеральная служба по надзору в сфере защиты прав потребителей и благополучия человека
3.1.2. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ. ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Серологические методы диагностики и мониторинга дифтерийной инфекции
Методические рекомендации
МР 3.1.2.0105—15
Серологические методы диагностики и мониторинга дифтерийной инфекции: Методические рекомендации.—М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2016.—16 с.
1. Разработаны ФБУН «НИИ эпидемиологии и микробиологии имени Пастера» (Г. Я. Ценева, Л. А. Краева); ФБУЗ «Центр гигиены и эпидемиологии в Вологодской области» (Б. В. Лимин, Е. А. Алексеева); ГБОУ ДПО РМАПО Минздрава России (О. А. Бургасова); Федеральной службой по надзору в сфере защиты прав потребителей и благополучия человека (А. А. Мельникова).
2. Утверждены руководителем Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Главным государственным санитарным врачом Российской Федерации А. Ю. Поповой 3 ноября 2015 г.
3. Введены впервые.
© Роспотребнадзор, 2016
© Федеральный центр гигиены и
эпидемиологии Роспотребнадзора, 2016
Содержание
I. Область применения. 4
II. Введение. 4
III. Общие положения. 5
IV. Группы населения, подлежащие обследованию.. 6
4.1. Серологический контроль состояния иммунитета у детей и
подростков. 6
4.2. Серологический контроль состояния иммунитета у взрослых. 6
V. Описание методов определения антител. 7
5.1. Реакция пассивной гемагглютинации (РПГА) 7
5.2. Реакция нейтрализации (РН) в культуре клеток Vero. 7
5.3. Иммуноферментный анализ (ИФА) 8
VI. Алгоритм контроля иммунитета населения и оценка его прогноза. 12
6.1. Оценка индивидуальной защищенности от дифтерийной инфекции. 12
6.2. Оценка коллективной защищенности от дифтерийной инфекции. 13
Приложение 1. Оборудование и материалы.. 14
Приложение 2. Список литературы.. 15
УТВЕРЖДАЮ
Руководитель Федеральной службы
по надзору в сфере защиты прав
потребителей и благополучия человека,
Главный государственный санитарный врач Российской Федерации
А. Ю. Попова
3 ноября 2015 г.
3.1.2. ЭПИДЕМИОЛОГИЯ. ПРОФИЛАКТИКА ИНФЕКЦИОННЫХ БОЛЕЗНЕЙ. ИНФЕКЦИИ ДЫХАТЕЛЬНЫХ ПУТЕЙ
Серологические методы диагностики и мониторинга дифтерийной инфекции
Методические рекомендации
МР 3.1.2.0105—15
I. Область применения
1.1. В методических рекомендациях (далее – МР) представлена рациональная и эффективная тактика использования серологических методов диагностики и мониторинга иммунитета к дифтерийной инфекции.
1.2. В настоящих МР описаны используемые в последние годы международные и отечественные методы определения противодифтерийных антител, а также предложен наиболее надежный и перспективный метод иммуноферментного анализа (далее – ИФА) для определения суммарных и высокоавидных антител, его стандартное применение, в том числе предложены надежные критерии оценки защитных уровней, необходимые для выявления среди детей и взрослых групп повышенного риска и оценки напряженности индивидуального и коллективного иммунитета к дифтерийной инфекции.
1.3. Настоящие МР предназначены для врачей-эпидемиологов и микробиологов и носят рекомендательный характер.
II. Введение
2.1. Несмотря на высокие показатели привитости населения от дифтерии в разных регионах России периодически регистрируются случаи заболевания дифтерией или носительства Corynebacterium diphtheria, особенно среди лиц в закрытых коллективах [3, 4, 8].
2.2. В настоящее время, спустя 15 лет после прошедшей эпидемии дифтерии, повсеместно отмечается снижение внимания клиницистов к этой инфекции. Профилактические и диагностические обследования проводятся, но не в полном объеме [12].
2.3. Как известно, защищенность от дифтерии в нашей стране определяется с помощью реакции прямой гемагглютинации (РПГА) [13]. Однако результат реакции, выражаемый в титрах, не позволяет точно определить количество антитоксических антител (АТ-АТ), а, значит, и оценить состояние иммунитета против дифтерии. Разработка и повсеместное внедрение в практику оценочной шкалы защищенности от дифтерии на основании определения количества АТ-АТ позволили контролировать качество вакцинации[1] [14]. Однако информация о количестве вырабатываемых противодифтерийных антител не всегда дает достоверный ответ на вопрос о степени защищенности от дифтерии. Это было продемонстрировано во время последней эпидемии дифтерии в России и после нее, когда у заболевших (до 40 % случаев) находили в крови
АТ-АТ защитных уровней [9, 10]. Проведенными исследованиями установлена определяющая роль высокоавидных АТ-АТ в защите от дифтерии, которые могут быть определены наряду с количеством суммарных АТ-АТ в иммуноферментном анализе [2, 5, 6, 16]. При этом была показана динамика формирования и утраты АТ-АТ, равно как и показателя их авидности, изучены особенности специфического иммунитета к дифтерии среди различных групп населения [1, 7, 11, 15]. Тем не менее, отсутствие программ и схем исследования при диагностике дифтерии и изучении напряженности иммунитета у населения, содержащих новые аргументированные данные, не позволяют полноценно и качественно проводить бактериологический и иммунологический контроль в отношении защищенности к дифтерии на местах.
III. Общие положения
3.1. Для постановки методов при проведении контроля иммунитета населения к дифтерии необходимо соблюдать требования санитарно-эпидемиологических правил СП 1.3.2322—08 «Безопасность работы с микроорганизмами III—IV групп патогенности (опасности) и возбудителями паразитарных болезней», утвержденных постановлением Главного государственного санитарного врача Российской Федерации от 28.01.2008 № 4 (зарегистрировано в Минюсте России 21.02.2008 № 11197).
3.2. Список оборудования и материалов, необходимых для проведения исследования, представлен в прилож. 1.
IV. Группы населения, подлежащие обследованию
4.1. Серологический контроль состояния иммунитета
у детей и подростков
4.1.1. Серологический контроль иммунитета в различных группах позволяет представить иммунологическую структуру населения и выявить группы повышенного риска, определить состояние вакцинального иммунитета как в ранние, так и в отдаленные сроки после вакцинации.
4.1.2. Серологический контроль состояния и длительности сохранения вакцинального иммунитета необходимо осуществлять систематически методом выборочного серологического обследования (мониторинга) различных групп населения в городах и сельских районах каждой области, края.
4.1.3. Обследованию подлежат привитые против дифтерии дети и подростки от 3 до 18 лет каждой возрастной группы (3 года, 4 года, 5 лет и т. д., особое внимание следует обратить на детей 9—13 лет).
4.1.4. Серологический контроль следует проводить, начиная с групп детей 3 лет не ранее, чем через 6 месяцев после последней прививки. К этому возрасту должен быть закончен первичный вакцинальный комплекс против дифтерии, включающий вакцинацию и первичную ревакцинацию (V и RV).
4.1.5. В случае отсутствия материально-технических возможностей обследования каждой возрастной группы детей и подростков можно отобрать возрастные группы, подлежащие очередной ревакцинации (4—5 лет, 9—10 лет, 14—15 лет).
4.1.6. При получении неудовлетворительных иммунологических показателей в этих группах контроль за иммунитетом следует провести в каждой возрастной группе.
4.2. Серологический контроль состояния иммунитета у взрослых
4.2.1. Наиболее подвержены заболеванию дифтерией следующие группы «риска»: лица старше 50 лет; рабочие промышленных предприятий, особенно занятые на вредном производстве; лица, страдающие туберкулезом, а также гепатитом С, СПИД, наркоманией и алкоголизмом.
4.2.2. Особое внимание должно уделяться лицам в закрытых коллективах.
V. Описание методов определения антител
5.1. Реакция пассивной гемагглютинации (РПГА)
Для определения уровней сывороточных АТ-АТ в крови здоровых людей в нашей стране используют реакцию пассивной гемагглютинации (РПГА), которая рекомендована методическими указаниями МУК 4.2.3065—13 «Лабораторная диагностика дифтерийной инфекции», утвержденными Главным государственным санитарным врачом Российской Федерации 14 июля 2013 г. Эта реакция имеет свои преимущества, состоящие в простоте постановки, быстроте получения результатов и экономичности.
Для постановки реакции используется диагностикум дифтерийный эритроцитарный антигенный. Поскольку срок годности эритроцитарных диагностикумов составляет 1 год, необходимо перед каждым проведением серологического исследования сывороток проверять активность препарата. Проверка проводится с контрольным антитоксином, приложенным к комплекту, либо используется национальный препарат дифтерийного антитоксина, очищенного ферментолизом и специфической сорбцией, диагностический сухой. Допускается исследование контрольной сыворотки (лабораторный образец) с известным титром дифтерийных антител. Если диагностикум выявляет в сыворотке антитела в концентрации на 2—3 разведения ниже, чем они в ней содержатся, то такой препарат не пригоден для дальнейшего исследования.
РПГА ставят в два этапа согласно инструкции, прилагаемой к препарату: 1-й – подготовка к реакции; 2-й – основной опыт. Ответ может быть получен на 2-е сутки с момента получения исследуемого материала лабораторией.
Однако ряд зарубежных исследователей отмечает возможность получения ложноположительных данных и несовпадение результатов, полученных в реакции нейтрализации in vivo и методах in vitro. По данным ряда авторов коэффициент корреляции между результатами, полученными в РПГА и РН, составляет всего 0,6.
5.2. Реакция нейтрализации (РН) в культуре клеток Vero
Как известно, «золотым стандартом» при определении антитоксических противодифтерийных антител является кожная проба на кроликах или морских свинках. Однако результат в этом тесте можно получить лишь спустя 4—7 дней, что ограничивает его применение при проведении исследований в клинической лаборатории, где результат должен быть получен в минимальные сроки.
Поэтому в качестве второго стандарта была принята реакция нейтрализации (РН) в культуре клеток Vero, поскольку она лишена недостатков биологического теста, более стандартна и наглядна. Коэффициент корреляции результатов, полученных в РН в культуре клеток Vero, с результатами, полученными в классическом методе (на лабораторных животных), составляет 0,98. Этот метод гораздо экономичнее, быстрее и проще в постановке. Однако достоверность результатов РН во многом определяется стандартностью культуры клеток и всех контролей (токсинов и антитоксинов).
В реакции используется цветная проба, основанная на способности токсина изменять метаболическую активность зараженных клеток, что определяют по цвету индикатора, содержащегося в питательной среде. В не пораженных токсином культурах клеток под влиянием выделяющихся продуктов клеточного метаболизма рН питательной среды сдвигается в кислую сторону, вызывая изменение цвета индикатора. В пораженных токсином культурах в результате дегенерации клеток их метаболическая активность подавляется, и цвет фенолового красного не изменяется или изменяется частично.
В реакции используется токсин 0,0002 Lf/мл и антитоксин 0,032 МЕ/мл (National Collection of Type Cultures Diphtheriae Reference Laboratory, Central Health Laboratory (CPHL), London, UK). При постановке реакций применяют культуру клеток Vero, получаемую из лаборатории детских вирусных инфекций НИИЭМ им. Пастера, в концентрации 2,5 · 105 клеток/мл. Содержание антитоксических антител определяют от 0,000125 МЕ/мл и выше.
5.3. Иммуноферментный анализ (ИФА)
В последние годы совершенствование иммунотехнологии позволило использовать иммуноферментные методы для определения антител, в том числе противодифтерийных. Эти реакции отличаются стабильностью, быстротой, удобством в постановке. В связи с этим в нашей стране (НПО «Биомед», Пермь) разработана и имеет регистрационное удостоверение № 09/600/22116 тест-система на основе твердофазного ИФА с адсорбированным в лунках планшета очищенным дифтерийным анатоксином. Конъюгатом служат иммуноглобулины (F(ab')2-фрагменты) диагностические против IgG человека, аффинноочищенные, меченные пероксидазой хрена.
Тест-система для ИФА представляет собой набор, предназначенный для определения суммарных антитоксических антител, и включает следующие реагенты: иммуносорбент 1-96-луночный полистироловый или хлорвиниловый планшет для иммунологических реакций, в лунках которого сорбирован анатоксин дифтерийный очищенный; конъюгат – иммуноглобулины (F(ab')2-фрагменты) диагностические против IgG человека, аффинноочищенные, меченные пероксидазой; контрольный положительный образец (К+) – сыворотка или плазма крови человека с известным титром дифтерийных антител; контрольный отрицательный образец (К-) – сыворотка или плазма крови человека, не содержащая дифтерийных антител; концентрат фосфатно-солевого буферного раствора с твином (ФСБ-Тх25); блокатор – белково-солевой раствор (Б); цитратно-фосфатный буферный раствор с перекисью водорода (ЦФБР); хромоген – тетраметилбензидин (ТМБ); стоп-реагент (СР) – 5 %-ый раствор серной кислоты. Специальная компьютерная программа, прилагаемая к набору, дает возможность производить перерасчет показателей оптической плотности в показатели антитоксических международных единиц.
Для определения индекса авидности противодифтерийных антитоксических антител в сыворотке (плазме) крови человека разработано дополнение к набору, которое включает в себя следующие ингредиенты: контрольный положительный образец высокоавидных антител (КА+) – сыворотка крови человека с известным индексом авидности противодифтерийных антитоксических антител (индекс авидности сыворотки указан на этикетке флакона); контрольный отрицательный образец низкоавидных антител (КА-) – сыворотка крови человека, содержащая противодифтерийные антитоксические антитела низкой авидности; фосфатно-солевой буфер, содержащий 3М калия роданистого для определения авидности противодифтерийных антитоксических антител (ФСБ-3МКрод). Набор рассчитан на исследование 29 образцов сыворотки (плазмы) крови для определения индекса авидности притиводифтерийных антитоксических антител.
Тест-система укомплектована национальным стандартом антитоксина, измеряемым в МЕ/мл. Расчет концентрации АТ проводится с учетом коэффициента по калибровочной кривой, что делает результаты более достоверными. Сравнительный анализ нейтрализующего эффекта испытуемых сывороток людей в клеточной культуре Vero и других линиях показал хорошую корреляцию (r = 0,91) с результатами, полученными в модифицированных вариантах ИФА, что подтверждает адекватность применения ИФА для измерения уровня антитоксического иммунитета к дифтерии у здоровых людей.
5.3.1. Определение уровня противодифтерийных АТ
с помощью тест-системы ИФА
1. Приготовить разведения исследуемых сывороток 1 : 20, 1 : 200, 1 : 2 000 на буферном растворе № 1 (содержимое флакона концентрата ФСБ-Тх25 развести в 600 мл дистиллированной воды, содержимое флакона с блокатором растворить в 5,0 мл дистиллированной воды, полученный раствор добавить в емкость с раствором ФСБ-Т и тщательно перемешать) в макропланшете непосредственно перед использованием.
2. Приготовить непосредственно перед использованием рабочие разведения: отрицательной сыворотки – 1 : 20, добавляя в содержимое флакона (0,2 мл) 3,8 мл буферного раствора; положительной сыворотки – 1 : 200 (отмерить 0,01 мл растворенного К+ и добавить 2,0 мл раствора № 1), из которого затем приготовить отдельно каждое разведение – 1 : 2, 1 : 4, 1 : 8 и 1 : 16 (в итоге получить пять разведений К+ – 1 : 200, 1 : 400, 1 : 800, 1 : 1 600 и 1 : 3 200).
3. Полистироловые планшеты с иммунобилизированным антитоксином трижды отмыть буферным раствором (в объеме 0,3 мл в каждую лунку), удалить буферный раствор, постукивая по сложенной в несколько слоев фильтровальной бумаге, помещенной на поддон.
4. Разведения К+ внести по 0,1 мл в лунки: А1 – 1 : 200, В1 – 1 : 400, С1 – 1 : 800, D1 – 1 : 1600, Е1 – 1 : 3 200. К- внести по 0,1 мл в лунки F1 и G1. В лунку Н1 внести 0,1 мл раствора № 1 («бланк»). Разведения исследуемых образцов сывороток крови внести по 0,1 мл в остальные лунки планшета (А2–Н12). Планшет герметично закрыть и выдержать (60 ± 5) мин при температуре (37 ± 1) °С.
5. После выдержки в термостате содержимое лунок слить в широкий сосуд с 3 %-м раствором хлорамина или 6 %-м раствором перекиси водорода. Планшеты промыть 5 раз раствором № 1 и удалить остатки жидкости.
6. В каждую лунку планшета, кроме Н1 («бланк»), внести по 0,1 мл раствора конъюгата (непосредственно перед использованием из флакона отобрать необходимый объем конъюгата и развести его раствором № 1 до указанного на этикетке рабочего разведения, тщательно перемешать). В лунку Н1 внести 0,1 мл раствора № 1. Планшет герметично закрыть и выдержать (60 ± 5) мин при температуре (37 ± 1) °С.
7. Удалить жидкость из лунок, планшеты промыть, как указано в пункте 5.
8. Внести в каждую лунку планшета по 0,2 мл раствора ТМБ (готовят непосредственно перед внесением в лунки планшетов). Для этого содержимое флакона с ТМБ перенести во флакон с ЦФБР и тщательно перемешать. Раствор готовить в защищенном от прямых солнечных лучей месте. Планшет выдержать при температуре (20 ± 2) °С в течение 20 мин в защищенном от света месте.
9. Реакцию остановить добавлением в каждую лунку по 0,1 мл стоп-реагента (СР).
10. Результаты ИФА регистрируют на спектрофотометре при двух длинах волн 450/620 нм. Выведение спектрофотометра на нулевой уровень («бланк») осуществляют по лункам вертикального ряда.
5.3.2. Определение индекса авидности противодифтерийных
антитоксических антител
1. Внести контрольные и исследуемые образцы. После внесения контролей К+, К- и раствора № 1 добавить КА+, КА- и все испытуемые сыворотки в двух повторностях (одну повторность КА+, КА- и рабочие сыворотки промыть раствором № 1, а вторую – 3М раствором калия роданистого). Планшет герметично закрыть и выдержать (60 ± 5) мин при температуре (37 ± 1) °С, следуя инструкции к набору для ИФА. Затем содержимое лунок собрать в сосуд с дезинфицирующим раствором (5—6 % раствор монохлорамина).
2. Первая промывка планшета.
Контроли К+, К- и первую повторность КА+, КА- и рабочих сывороток промыть 5 раз раствором № 1, вторую повторность КА+, КА- и рабочих сывороток промыть 4 раза 3МКрод, а 5-й раз – раствором № 1.
3. Далее все этапы реакции выполнить согласно основной инструкции к набору.
Регистрация и оценка результатов
Результаты ИФА регистрируют на спектрофотометре при двух длинах волн 450/620 нм.
Индекс авидности (ИА) рассчитывают по формуле:
 100 %, где (1)
100 %, где (1)
ОП(ФСБ – 3МКрод) – оптическая плотность в лунках, обработанных раствором детергента (ФСБ-3МКрод), ОП(Раствор № 1) – оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе (раствор № 1).
КА+ должен содержать высокоавидные противодифтерийные антитоксические антитела с индексом авидности не менее 90 %. КА- должен содержать низкоавидные противодифтерийные антитоксические антитела с индексом авидности не более 10 %.
Индекс авидности рабочих сывороток более 30 % соответствует вероятности защиты от заболевания дифтерией на 95 %, а индекс авидности 10 % является показателем критического уровня, ниже которого вероятность заболевания возрастает до 99 %.
Пример расчета
1. Показатель ОП рабочей сыворотки в лунке, обработанной
ФСБ-3МКрод, равен 0,24, а в лунке, обработанной раствором № 1, равен 0,37. Индекс авидности, рассчитанный по приведенной формуле, равен 65 %, что соответствует высокой степени защиты от дифтерии (более 30 %).
2. Показатель ОП рабочей сыворотки в лунке, обработанной
ФСБ-3МКрод, равен 0,05, а в лунке, обработанной раствором № 1, равен 0,62. Индекс авидности, рассчитанный по приведенной формуле, равен 8 %, что соответствует низкой степени защиты от дифтерии (менее 10 %).
VI. Алгоритм контроля иммунитета населения
и оценка его прогноза
6.1. Оценка индивидуальной защищенности
от дифтерийной инфекции
Этап 1. Отобрать кровь у обследуемого в пробирку с активатором свертывания. Внести в систему баз данных информацию об обследуемом по форме (табл. 1).
Таблица 1
| Возраст | Прививочный статус | Профессия или учебное заведение | Наличие хронического или острого заболевания | Дата заболевания | Есть или нет подозрение на дифтерию |
Этап 2. Определить с помощью ИФА тест-системы и 3М роданистого калия количество противодифтерийных антитоксических антител, выраженное в МЕ/мл, и индекс авидности антител, выраженный в %. Количество антител рассчитать по данным оптической плотности в лунках планшета с помощью компьютерной программы, входящей в качестве приложения к тест-системе. Индекс авидности (ИА) антител рассчитать по формуле:
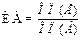 100 %, где (2)
100 %, где (2)
ОП(Е) – оптическая плотность в лунке, обработанной детергентом, ОП(А) – оптическая плотность в лунке, обработанной обычным промывочным раствором, используемым в тест-системе.
Этап 3. Сделать прогноз защищенности обследуемого на будущее. Поскольку авидность антител, защищающая от заболевания дифтерией, снижается быстрее, чем количественный показатель суммарных антител, то в прогнозе необходимо ориентироваться на индекс авидности антител. Для этого найти на графике (рис. 1) значение, наиболее приближенное к полученному индексу авидности антител (с учетом прошлой вакцинации, если она была проведена в ближайший год), и определить по графику, через сколько месяцев индекс авидности снизится до критической отметки (10 %). Очередную ревакцинацию (или повторное исследование) рекомендуется пройти до этой даты.

Рис. 1. Математическая модель из исходных данных
о динамике индексов авидности после ревакцинации
Примечания. IND_AVID (%) – индексы авидности (%), Т(мес.) – время после ревакцинации (месяцы). Средняя погрешность модели = 5 %.
Этап 4. Если обследуемый относится к группе «риска» по заболеванию дифтерией, то нужно учесть, что у таких лиц можно ожидать снижение индекса авидности антител в гораздо более ранние сроки, чем у лиц, не входящих в группу риска. Поэтому очередное исследование на напряженность иммунитета необходимо перенести на более ранний срок.
6.2. Оценка коллективной защищенности
от дифтерийной инфекции
Этап 1. Определить контингент для изучения напряженности иммунитета к дифтерии с учетом групп риска. Исследование лучше проводить спустя 3—5 лет после очередной ревакцинации. Отобрать кровь для исследования. Заполнить индивидуальную информацию в базе данных для каждого обследуемого
Этап 2. Определить индивидуальные показатели защищенности от дифтерии и рассчитать вероятность заболевания на момент обследования. Затем определить средние показатели для всей группы обследованных.
Этап 3. Определить прогноз для всего коллектива в отношении динамики авидности антитоксических антител. Рассчитать сроки очередного обследования или вакцинации.
Все рекомендуемые мероприятия не идут в разрез с нормативными документами по вакцинопрофилактике и контролю иммунитета, а предполагают индивидуальный подход ко всем обследуемым лицам и повышенное внимание к представителям из групп риска.
Приложение 1
Оборудование и материалы
1. Стандартное оборудование клинических лабораторий для взятия крови.
2. Стандартное оборудование для проведения серологических реакций.
3. Ламинарный или настольный бокс, ТУ 9452003-215-04087-5.
4. Фотометр микропланшетный (ридер).
5. Тест-система для ИФА – набор, предназначенный для определения суммарных антитоксических антител на основе конъюгата – иммуноглобулины (F(ab')2-фрагменты) диагностические против IgG человека, аффинноочищенные, меченные пероксидазой (производство НПО «Биомед», г. Пермь). Специальная компьютерная программа, прилагаемая к набору, дает возможность производить перерасчет показателей оптической плотности в показатели антитоксических международных единиц.
Приложение 2
Список литературы
1. Алексеева Е.А. Оптимизация мониторинга противодифтерийного иммунитета детей в Вологодской области / Е.А. Алексеева, Л.А. Краева, Г.Я. Ценева, Г.И. Беспалова // Материалы X Съезда ВНПОЭМП. Инфекция и иммунитет. Москва, 2012. № 2. С. 77—78.
2. Алексеева Е.А. Эффективность высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции / Е.А. Алексеева, Л.А. Краева, Г.Я. Ценева, А.М. Николаева //Профилактическая и клиническая медицина. 2011. № 1. С. 38.
3. Васильев К.Г., Савчук А.И. Клинико-эпидемиологические аспекты вакцинации против дифтерии //Первый конгресс педиатров-инфекционистов России. М., 2002. С. 26.
4. Краева Л.А. Качественные показатели антитоксических антител в оценке противодифтерийного иммунитета / Л.А. Краева, Ф.С. Носков, Г.Я. Ценева // Ж. мед. иммунол. С.-Пб., 2005. Т. 7. № 2—3. C. 274.
5. Краева Л.А. К вопросу о протективных противодифтерийных антителах и методика их определения / Л.А. Краева // Материалы всеросс. научно-практич. конф. «Создание и перспективы применения медицинских иммунобиологических препаратов». Пермь, 2008. С. 58—59.
6. Краева Л.А. Новые подходы к оценке защищенности от дифтерийной инфекции / Л.А. Краева, Г.Я. Ценева, А.М. Николаева, Е.А. Алексеева // Материалы 4-ой международной конференции «Идеи Пастера в борьбе с инфекциями». С.-Пб., 2008. С. 15.
7. Краева Л.А. Роль высокоавидных антитоксических антител в оценке невосприимчивости к дифтерийной инфекции / Л.А. Краева, Г.Я. Ценева, А.М. Николаева, Е.А. Алексеева // Эпидемиология и инфекционные болезни. 2011. № 4. С. 20—24.
8. Краева Л.А. Показатели иммунитета к дифтерии у населения Северо-Западного округа РФ и пути оптимизации мониторинга инфекции / Л.А. Краева, Г.Я. Ценева, Л.А. Липатова, Е.А. Алексеева, М.А. Кузакова // Материалы научно-практической конференции, посвященной 90 лет ГСЭС Ленинградской области «Актуальные вопросы обеспечения санитарно-эпидемиологического благополучия Ленинградской области». 2012. С. 197—200.
9. Краева Л.А., Ценева Г.Я. Особенности биологических свойств С. diphtheriae, циркулирующих в постэпидемический период // Ж. микробиол. и эпидемиол. 2009. № 3. С. 3—6.
10. Харченко Г.А., Чанпалова Л.С., Харченко О.Г. Дифтерия у привитых детей // VI Росс. съезд врачей-инфекционистов. С.-Пб., 2003. С. 413—414.
11. Ценева Г.Я. Скрининговые исследования иммунитета к дифтерии и коклюшу в Санкт-Петербурге и проблемы контроля невосприимчивости / Г.Я. Ценева, Л.А. Краева, Н.Н. Курова // Мат-лы междунар. конф. «Развитие научных исследований и надзор за инфекционными заболеваниями». С.-Пб., 2010. С. 82.
12. Ценева Г.Я. Уровень антитоксического противодифтерийного иммунитета у населения Северо-Западного округа РФ и пути оптимизации мониторинга инфекции / Г.Я. Ценева, Л.А. Краева, Е.Е. Щедеркина // Эпидемиология и вакцинопрофилактика. 2010. № 5 (54). С. 51—54.
13. Эритроцитарный дифтерийный антигенный жидкий диагностикум производства «Биомед» им. И.И.Мечникова: Инструкция.
14. Efstratiou A., Maple P.A.C. Manual for the laboratory diagnosis of diphtheria. Copenhagen //The Expanded Programme on Immunization in the European Region of WHO. 1994 (ICP/EPI038).
15. Kraeva L.A. Ways of optimization of monitoring and prophylaxis of diphtheria infection. / L.A. Kraeva, S.B. Krayev, G.Ya. Tseneva //Eighth International Meeting of ELWG on Diphtheria. Copenhagen. 2004. Abstr. Book A 5.9. P. 55.
16. Tseneva G.J. Definition high-avidity antidiphtherial anti-bodies and their value in protection against of diphtheria / G.J. Tseneva, A.M. Nikolaeva, L.A. Kraeva // Ninth International Meeting of the European Laboratory Working Group on Diphtheria, ELGWD and Diphtheria Surveillance Network (DIPNET). Vouliagmeni, Greece. 2006. Р. 56.
[1] < 0,01 МЕ/мл – обследуемый восприимчив к дифтерии,
0,01 МЕ/мл – минимальная степень защиты,
0,01—0,09 МЕ/мл – некоторая степень защиты,
0,1—0,9 МЕ/мл – защитный уровень антител,
1,0 и > МЕ/мл – стойкая длительная невосприимчивость к дифтерии.
|
из
5.00
|
Обсуждение в статье: Серологические методы диагностики и мониторинга дифтерийной инфекции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

