 |
Главная |
Законы идеального газа
|
из
5.00
|
Газовые законы были установлены экспериментально до создания МКТ.
Идеальный газ - газ в котором: 1) объём всех молекул пренебрежимо мал по сравнению с объёмом газа (SVмол.<<Vгаза); 2) потенциальная энергия взаимодействия между молекулами пренебрежимо мала по сравнению с суммой кинетических энергий отдельных его молекул (SЕпот.<< SEк).
Макроскопические параметры (р, V, T, rи др.) характеризуют газ в целом; именно эти параметры регистрируют измерительные приборы. Уравнение, устанавливающее взаимосвязь между макроскопическими параметрами, называют уравнением состояния.
 1. Закон Бойля(1662г.)и Мариотта(1667г.) для изотермического процесса.
1. Закон Бойля(1662г.)и Мариотта(1667г.) для изотермического процесса.
При m = const и Т = const
p × V = const.
 2. Закон Шарля(1787 г.) для изохорического процесса.
2. Закон Шарля(1787 г.) для изохорического процесса.
При m = const и V = const
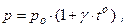
где g - термодинамический коэффициент давления газа.
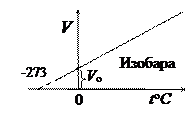 3. Закон Гей-Люссака(1802 г.) для изобарического процесса. При m = const и р = const
3. Закон Гей-Люссака(1802 г.) для изобарического процесса. При m = const и р = const
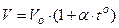
где a - коэффициент объёмного расширения газа.
Изохора и изобара пересекают ось температуры при to=-273,16оС; эту температуру называют абсолютным нулём температуры. Поэтому из законов Шарля и Гей-Люссака следует, что 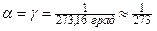 град-1.
град-1.
В XIX в. англичанином Кельвином предложена термодинамическая шкала температур: T= 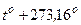 ,но 1 K =1oC !
,но 1 K =1oC !
 Отметим, что при Т®0,движение не исчезает, прекращается лишь тепловое движение атомов и молекул. Например, при Т ® 0орбитальное движениеэлектронов в атоме не прекращается. В настоящее время уже достигли Т » 0,003 K. Кроме того, стремление к нулю давления и объёма в законах Шарля и Гей-Люссака, при to®-273o, означает лишь то, чтопри низких температурах газы нельзя рассматривать как идеальные.
Отметим, что при Т®0,движение не исчезает, прекращается лишь тепловое движение атомов и молекул. Например, при Т ® 0орбитальное движениеэлектронов в атоме не прекращается. В настоящее время уже достигли Т » 0,003 K. Кроме того, стремление к нулю давления и объёма в законах Шарля и Гей-Люссака, при to®-273o, означает лишь то, чтопри низких температурах газы нельзя рассматривать как идеальные.
Законы Шарля и Гей-Люссака часто записывают и в другом виде:
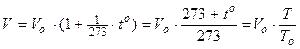 Þ
Þ
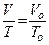 Þ
Þ 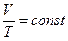 ;
;
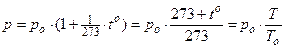 Þ
Þ
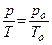 Þ
Þ 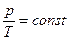 .
.
Парциальным давлением газа, входящего в газовую смесь, называют давление, которое создавал бы этот газ, если бы он занимал весь объём, предоставленный смеси (т.е. если удалить все другие компоненты смеси).
4. Закон Дальтона(1801 г.): давление газовой смеси равно сумме парциальных давлений всех газов смеси: 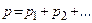 +pn, т.е. молекулы данного газа, входящего в состав смеси, "не замечают" молекул других компонент смеси.
+pn, т.е. молекулы данного газа, входящего в состав смеси, "не замечают" молекул других компонент смеси.
5. Закон Авогадро(1811 г.): при одинаковых ри Тодин моль любого газа занимает один и тот же объём. В частности, при р=poи Т=To(гдеpo 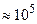 Па , To
Па , To 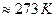 -значения давления и температуры при нормальных условиях) объём 1 моля любого газа равен 22,4л(итра).
-значения давления и температуры при нормальных условиях) объём 1 моля любого газа равен 22,4л(итра).
6. Закон Клапейрона(1834 г.) объединяет законы Бойля-Мариотта, Шарля и Гей-Люссака: 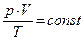 .
.
7. Уравнение Клапейрона - Менделеева (1875 г.):
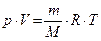 , где
, где 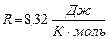 - универсальная газовая постоянная.
- универсальная газовая постоянная.
5.5. O сновное уравнение МКТ(уравнение Клаузиуса)
Оно получено для идеального газа и устанавливает связь между таким макропараметром как давление ри средней скоростью молекул газа 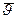 (или средней кинетической энергией
(или средней кинетической энергией 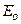 молекул).
молекул).
По определению, давление рассчитывают по формуле: 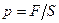 , где S - площадь участка стенки; но F = m×a =
, где S - площадь участка стенки; но F = m×a = 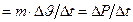 (где Р - импульс тела).
(где Р - импульс тела).
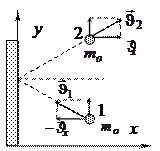
Давление газа на стенки складывается из импульсов отдельных молекул 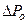 , т.е.:
, т.е.: 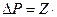
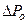 , где Z - число ударов о площадку Sза
, где Z - число ударов о площадку Sза 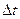 .
.
Но Z= S×n× 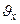 ×Dt×
×Dt× 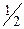 ; где n - концентрация молекул газа в сосуде, а
; где n - концентрация молекул газа в сосуде, а 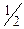 объясняется тем, что в силу хаотичности движения молекул только половина из них имеет
объясняется тем, что в силу хаотичности движения молекул только половина из них имеет 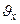 , направленную к рассматриваемой стенке. Кроме того,
, направленную к рассматриваемой стенке. Кроме того,
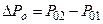 =
= 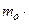
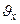 -
- 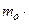 (-
(- 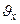 )=2
)=2 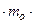
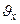 . Тогда:
. Тогда: 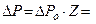 2
2 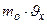 ×
× 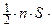
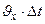 =
= 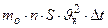 .
.
 При
При 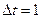 с, имеем:
с, имеем: 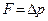 =
= 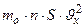 . А средняя сила, действующая на площадку S стенки:
. А средняя сила, действующая на площадку S стенки: 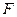 =
= 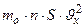 . Так как движение молекулы во всех трёх направлениях равновероятно, то:
. Так как движение молекулы во всех трёх направлениях равновероятно, то: 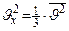 . Тогда
. Тогда 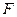 =
= 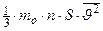 .
.
Таким образом, выражение для давления принимает вид:
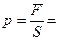
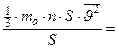
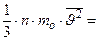
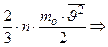
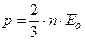 .
.
 Откуда, учитывая, что
Откуда, учитывая, что 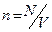 , получим уравнение Клаузиуса:
, получим уравнение Клаузиуса: 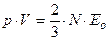 .
.
Температура
В быту понятие "температура" определяют как величину, характеризующуюстепень нагретостител. Такое определение основано на физиологическом восприятии состояния тела. Но характеристика теплового состояния тела на ощупь, во-первых, не всегда возможна (имеет ограниченный температурный диапазон), во-вторых, субъективна (при одинаковой температуре металлические предметы на ощупь холодны, а деревянные - теплы).
С точки зрения физики, температура (Т) - мера содержащейся в теле теплоты, особой формы энергии, обусловленной тепловым (хаотическим) движением молекул. Температура - макроскопический параметр, определяющий направление перехода тепла (от более к менее нагретому телу).
Температура относится к классу интенсивных величин, которые, в отличие от экстенсивныхвеличин (длины, объёма, массы и т.п.), не подчиняются закону аддитивности (нельзя, смешав две порции воды с одинаковой Т,получить воду с более высокой Т), т.е. температуры тел не складываются.
Основное свойство температуры: температуры тел, образующих изолированную систему и находящихся в тепловом контакте, постепенно выравниваются, и система приходит в состояние термодинамического равновесия, т.е. такого состояния, при котором все макроскопические параметры системы остаются сколь угодно долго неизменными и одинаковыми во всех её частях.
Для измерения Т используют термометры, действие которых может быть основано на различных принципах:
1) 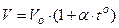 , при р = const;
, при р = const;
2) 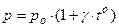 , при V = const;
, при V = const;
3) термопарные (использующие зависимость контактной разности электропотенциалов от температуры);
4) болометрические (использующие зависимость электрического сопротивления материалов от температуры);
5) фотометрические (использующие зависимость спектра излучения тела от его температуры); это единственный вид бесконтактных термометров;
6) жидкокристаллические (используется зависимость организации молекул некоторых органических веществ от температуры).
В бытовых термометрах (спиртовых и ртутных) используют зависимость V= 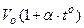 для жидкостей. В научных - чаще используют газовые термометры, у которых зависимость
для жидкостей. В научных - чаще используют газовые термометры, у которых зависимость 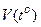 более линейна, чем у жидкостных.
более линейна, чем у жидкостных.
Замечание: термометр (кроме фотометрического) никогда не показывает температуру объекта сразу; из-за тепловой инерционности необходимо время, чтобы термометр пришёл в тепловое равновесие с телом, причём теплоёмкость термометра должна быть значительно меньше теплоёмкости тела (объекта исследований), иначе он будет изменять, а не измерять температуру тела.
|
из
5.00
|
Обсуждение в статье: Законы идеального газа |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

