 |
Главная |
Необратимость реальных термодинамических (т/д) процессов
|
из
5.00
|
Лекция № 6
Термодинамика
Слово "термодинамика" состоит из двух греческих слов: "терме" – теплота и "динамис" - сила. Термодинамика возникла как наука о процессах, происходящих в тепловых машинах, т.е. как наука о превращении внутренней энергии в механическое движениеи работу.
Необратимость реальных термодинамических (т/д) процессов
Т/д процесс - процесс, сопровождающийся превращением внутренней энергии в другие виды энергии (или наоборот). Поэтому, термодинамика - раздел молекулярной физики, изучающий т/д процессы.
Т/д равновесие – такое состояние изолированной системы тел (в частности, газа), при котором все её макроскопические параметры остаются сколь угодно долго неизменными и одинаковыми во всех частях системы.
Т/д процесс 1  2называют обратимым, если возможен переход 2®1по той же траектории на графике p(V), после чего ни в системе, ни в окружающей среде не остаётся никаких изменений. Цифры 1и2 обозначают номер равновесного состояния т/д системы. Примером обратимого т/д процесса могут служить колебания математического маятника (в отсутствии силы трения).
2называют обратимым, если возможен переход 2®1по той же траектории на графике p(V), после чего ни в системе, ни в окружающей среде не остаётся никаких изменений. Цифры 1и2 обозначают номер равновесного состояния т/д системы. Примером обратимого т/д процесса могут служить колебания математического маятника (в отсутствии силы трения).
Однако все реальные процессы являются необратимыми. Например, рассмотрим адиабатический (  ) процесс расширения газа в пустоту (
) процесс расширения газа в пустоту (  ). При этом
). При этом  , откуда
, откуда  . Для обратимости процесса необходимо вернуть все молекулы газа в сосуд. Но, для преодоления сил давления газа на орудие сбора молекул, придётся совершить работу
. Для обратимости процесса необходимо вернуть все молекулы газа в сосуд. Но, для преодоления сил давления газа на орудие сбора молекул, придётся совершить работу  . Поэтому, после завершения сбора молекул в сосуд, получим
. Поэтому, после завершения сбора молекул в сосуд, получим 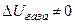 . Таким образом, хотя мы и вернули молекулы газа в сосуд, но при этом "наследили" (т.е. произвели изменения) как в системе (нагрели газ), так и в окружающей среде (уменьшили её внутреннюю энергию на
. Таким образом, хотя мы и вернули молекулы газа в сосуд, но при этом "наследили" (т.е. произвели изменения) как в системе (нагрели газ), так и в окружающей среде (уменьшили её внутреннюю энергию на  ).
).
6.2. Первое начало (закон) термодинамики
Оно является результатом обобщения многовекового опыта человечества и представляет собой закон сохранения и превращения энергии в термодинамике. Установление этого закона связано с именами немецкого врача Майера, который в 1842 году пришёл к идее о возможности взаимного превращения тепла и работы, английского физика Джоуля, который в 1843 году первым измерил механический эквивалент теплоты, и немецкого учёного Гельмгольца, сформулировавшего в 1847 году этот закон и понявшего его смысл как закона сохранения энергии.
Def .: Теплота  ,сообщаемая системе, расходуется на изменение её внутренней энергии
,сообщаемая системе, расходуется на изменение её внутренней энергии  и на совершение ею работы A против внешних сил:
и на совершение ею работы A против внешних сил:
 .
.
В случае циклического теплового двигателя система должна периодически возвращаться в исходное состояние. Но при таком возврате изменения внутренней энергии не должно происходить, т.е.  . Тогда из 1-го начала имеем
. Тогда из 1-го начала имеем  , т.е. система может совершить работу равную (но не большую!) количеству сообщённой ей теплоты. Это означает, что невозможно создать периодически действующий тепловой двигатель, который совершал бы работу, превышающую получаемую им энергию. Таким образом, первый закон термодинамики отвергает возможность создания вечного двигателя первого рода (устройства, циклически выполняющего работу без энергопотребления). В связи с этим Французская академия наук в 1775 году (намного раньше формулировки 1-го начала термодинамики) приняла решение о прекращении рассмотрения проектов вечного двигателя.
, т.е. система может совершить работу равную (но не большую!) количеству сообщённой ей теплоты. Это означает, что невозможно создать периодически действующий тепловой двигатель, который совершал бы работу, превышающую получаемую им энергию. Таким образом, первый закон термодинамики отвергает возможность создания вечного двигателя первого рода (устройства, циклически выполняющего работу без энергопотребления). В связи с этим Французская академия наук в 1775 году (намного раньше формулировки 1-го начала термодинамики) приняла решение о прекращении рассмотрения проектов вечного двигателя.
|
из
5.00
|
Обсуждение в статье: Необратимость реальных термодинамических (т/д) процессов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

