 |
Главная |
Растворы (продолжение).
|
из
5.00
|
Лекция №5.
Растворы.
План лекции:
1. Дисперсные системы, их классификация.
2. Способы выражения концентрации растворов. Растворимость.
3. Электролитическая диссоциация.
4. Ионное произведение воды. Водородный показатель.
5. Ионнообменные реакции. Гидролиз солей.
6. Смещение равновесия при растворении. Индикаторы.
Фаза – это совокупность частей физико-химической системы, обладающих одинаковыми физическими и химическими свойствами. Гетерогенные дисперсные системы содержат несколько фаз (по крайней мере две), равномерно распределенных друг в друге. Из них различают непрерывную фазу, называемую дисперсионной средой, и раздробленную, дискретную, называемую дисперсной фазой. Чаще всего фазы состоят из различных веществ, т.е. большинство гетерогенных дисперсных систем являются многокомпонентными, например, цементный раствор, состоящий из дисперсионной среды – воды и твердой дисперсной фазы – частиц цементного клинкера. Очевидными признаками гетерогенных дисперсных систем также являются наличие в них границ раздела фаз и непостоянство состава (его можно произвольно изменять в некоторых пределах).
Гетерогенные дисперсные системы классифицируют по двум признакам. Во-первых, в зависимости от размера частиц дисперсной фазы (d) они разделяются на грубодисперсные (d > 10-7 м) и коллоидные (d от 10-7 до 10-9 м). Во-вторых, в зависимости от агрегатного состояния фаз различают пены (газообразная дисперсная фаза в жидкой или твердой дисперсионной среде), эмульсии (жидкая дисперсная фаза в жидкой или твердой дисперсионной среде) и золи (твердая дисперсная фаза в жидкой, газообразной или твердой дисперсионной среде).
Растворы – это гомогенные многокомпонентные системы, не имеющие строго определенного состава (его, как и состав гетерогенных дисперсных систем, можно изменять, иногда в очень широких пределах). В них нет отдельных различных фаз и нет границ раздела. Размер частиц растворенных веществ соизмерим с размером структурных частиц веществ - молекул, ионов, атомов (d < 10-9 м). Если один из компонентов раствора находится в большем количестве, чем другие, то его называют растворителем. Другие компоненты в этом случае называют растворенными веществами. Растворителем считают также то вещество, агрегатное состояние которого при образовании раствора не изменяется. В зависимости от агрегатного состояния растворителя растворы бывают жидкими, газообразными и твердыми.
1. Молярная концентрация (с) показывает, сколько молей растворенного вещества содержится в 1 литре раствора:
с = n1/V3 = m1/M1V3, моль/л. (5.8)
2. Эквивалентная концентрация или нормальность (сэ) показывает, сколько молей эквивалентов вещества (nэ) содержится в 1 литре раствора:
сэ = nэ(1) / V3 = m1 / Mэ(1) V3, моль/л. (5.9)
3. Моляльная концентрация, или моляльность, (b) показывает, сколько молей вещества содержится в 1 кг растворителя:
b = n1 / m2 = m1 / M1m2, моль/кг растворителя. (5.10)
4. Мольная доля (хi) – это отношение числа молей одного из компонентов раствора к сумме молей веществ, входящих в раствор. Для бинарного раствора х1 + х2 = 1.
x1 = n1 / (n1 + n2), x2 = n2 / (n1 + n2), (5.11)
х1- мольная доля растворенного вещества; х2 - мольная доля растворителя.
5. Массовая (ωi) или объемная (φi) доли одного из компонентов раствора являются безразмерными величинами, равными отношению массы или объема растворенного вещества к общей массе или к общему объему раствора:
ω1 = m1 / m3, φ1 = V1 / V3. (5.12)
6. Титр раствора (Т) – это число граммов растворенного вещества в 1 см3 (1 мл) раствора. Он определяется отношением массы растворенного вещества (m1 в г) к объему раствора (V3 в мл):
Т = m1 / V3, г / мл. (5.13)
Опытным путем установлено, что вещества лучше растворяются в тех растворителях, которые химически им подобны. Это обобщение часто формулируется в виде более простой фразы: подобное растворяется в подобном. Рассматриваемое обобщение можно сформулировать еще одним способом: вещества с одинаковым типом межмолекулярных сил притяжения имеют тенденцию к взаимной растворимости. Словом “растворимость” называют явление, но им называют и понятие, которое имеет строгое определение. Для того, чтобы его сформулировать, необходимо знать, что такое насыщенный раствор. Это раствор, который при данной температуре находится в равновесии с избытком растворенного вещества. Например, для вещества А(к) выполняется следующее равновесие:
А(к) ⇆ А(водн).
Концентрация вещества в растворе при этом достигает максимально возможной величины. Количество вещества в молях в насыщенном растворе, отнесенное к объему раствора (л), называется растворимостью ( L ).
Электролитами называются вещества, которые при определенных условиях (в расплавах и растворах) распадаются на положительные и отрицательные ионы. Этот процесс получил название электролитической диссоциации. Электролиты разделяются на сильные и слабые. Слабые электролиты диссоциируют на ионы частично.
| α = | число молекул, распавшихся на ионы | . | (5.16) |
| число молекул, введенных в раствор |
Степень диссоциации электролита выражается долями единицы. За единицу принимаются все молекулы. Если часть их диссоциирует на ионы и равна α, то (1 - α) – доля недиссоциированных молекул. К растворам слабых электролитов применимы все законы химического равновесия. Так, для диссоциации этановой (уксусной) кислоты (слабого электролита), происходящей по уравнению:
СН3СООН ⇆СН3СОО - + Н + , (5.17)
константа химического равновесия равна:
| К = | с (СН3СОО-) · с (Н +) | . (5.18) |
| с (СН3СООН) |
Она характеризует способность электролита диссоциировать на ионы, не зависит от концентрации электролита, а зависит от его природы и температуры и в данном случае называется константой диссоциации (Кд). В отличие от величин Кд, значения α слабых электролитов зависят от концентрации растворов.
Кд = α2с / (1- α). (5.19)
Уравнение (5.19) называется законом разбавления Оствальда. При α<<1 уравнение (5.19) можно упростить, получив закон разбавления Оствальда для слабого бинарного электролита в виде:
Кд @ α2с. (5.20)
По (5.20) видно, что при разбавлении растворов слабых электролитов степень их диссоциации возрастает. В растворах слабых многоосновных кислот устанавливаются ступенчатые равновесия.
Сильные электролиты полностью распадаются на ионы и существуют в растворах только в виде ионов. К ним относятся почти все соли. Гидроксиды щелочных и щелочно-земельных металлов и некоторые кислоты: HClO4, HI, HBr, HCl, H2SO4 (по 1-ой ступени диссоциации), HClO3, HNO3. В их растворах α = 1 и нет равновесия между растворенными молекулами и ионами, например:
NaCl → Na+ + Cl-, NaOH → Na+ + OH -. (5.22)
И если концентрация электролита достаточно большая, то возникает явление кажущегося снижения степени диссоциации, и она называется кажущейся степенью диссоциации.
Для описания состояния ионов в этих случаях пользуются, наряду с концентрацией ионов, их активностью, т.е. условной или эффективной концентрацией ионов, в соответствии с которой они действуют в химических процессах:
а = fс. (5.23)
Диссоциация воды выражается уравнением:
2Н2О ⇆Н3О+ + ОН -. (5.24)
Для (5.24) выражение константы равновесия примет следующий вид:
К = с (Н+)с (ОН-) / с (Н2О) = 10-7·10-7 / 55,55 = 1,8·10-16 (моль / л). (5.25)
Произведение К·с (Н2О) можно принять в качестве другой константы Кв, называемой ионным произведением воды:
Кв = с (Н+) с(ОН-) = 10-7·10-7 = 10-14 (при 25°С). (5.26)
В кислых растворах ионов водорода больше, чем 10-7 моль / л, а гидроксид-ионов меньше, чем 10-7 моль/л. Для упрощения:
рН = -lgс (Н+); рОН = -lgс (ОН-). (5.27)
рН + рОН = 14; р Кв = 14. (5.28)
Водородный показатель рН используется чаще, и по его значению определяют кислотность или щелочность водных растворов:
| Реакция среды | с(Н+) моль / л | с(ОН-) моль / л | рН | рОН |
| кислая | 1¸10-6 | 10-14¸10-8 | 0¸6 | 14¸8 |
| нейтральная | 10-7 | 10-7 | 7 | 7 |
| щелочная | 10-8¸10-14 | 10-6¸1 | 8¸14 | 6¸0 |
В водных растворах электролитов между ионами могут протекать реакции, называемые обменными реакциями, к которым применимы принципы химического равновесия. Так, между хлоридом железа III и гидроксидом натрия будет протекать ионнообменная реакция с образованием осадка:
Fe Cl3 + 3 NaOH → Fe(ОН)3 ↓ + 3NaCl. (5.29)
(молекулярная форма)
Fe3+ + 3 Cl - + 3 Na + + 3 ОН- → Fe(ОН)3 ↓ + 3 Na + + 3 Cl -,
Реагируют между собой только ионы Fe3+ и ОН-, для них можно написать отдельно уравнение в ионно-молекулярной форме:
Fe3+ + 3 OH- → Fe (OH)3 ↓.
Например, так выглядят уравнения реакции с выделением газа (5.30) и уравнения реакции образования слабого электролита (5.31):
Na2CO3 + 2 HCl → 2NaCl + CO2 ↑ + H2O, (5.30)
CO32- + 2 H+ → CO2 + H2O;
KCN + HCl → HCN + KCl, (5.31)
CN- + H+ → HCN.
Другим примером образования молекул слабого электролита служат реакции нейтрализации, по которым ионы Н+ и ОН- соединяются в почти недиссоциирующие молекулы воды:
КОН + НС1→ КС1+ Н2О. (5.32)
К ионообменным реакциям относится гидролиз. Гидролизом называются реакции разложения веществ водой.
Так, при гидролизе соли, образованной слабой кислотой и сильным основанием в растворе, оказывается больше ионов ОН-, и он становится основным:
СН3СООNa + Н2О ⇆ СН3СООН + NaОН, (5.33)
СН3СОО - + Н2О ⇆СН3 СООН + ОН-.
В результате гидролиза соли, образованной сильной кислотой и слабым основанием, раствор становится кислым:
NH4Cl + H2O ⇆ NH4OH + HCl, (5.34)
NH4+ + H2O ⇆NH4OH + H+.
При равенстве Кд(кисл) и Кд (осн) среда раствора будет нейтральной (рН=7), например:
СН3СООNH4 + Н2О ⇆ СН3СООН + NH4OH, (5.35)
CH3COO- + NH4+ + H2O ⇆ CH3COOH + NH4OH.
В случае солей, состоящих из многозарядных ионов слабых электролитов, гидролиз идёт ступенчато и часто не до конца:
Na2S + H2O ⇆ NаHS + NaOH, (5.36)
S2- + H2O ⇆ HS- + OH- ;
Al2 (SO4)3 + 2H2O ⇆ 2 Al (OH)SO4 + H2SO4, (5.37)
2Al3+ + 2H2O ⇆ 2 Al (OH)2+ + 2 H+.
Соли, образованные сильными основаниями и сильными кислотами, гидролизу не подвергаются.
В ряду электролитов выделяют особую группу веществ – амфотерные электролиты. К ним относят гидроксиды металлов: Be(OH)2; Zn ( OH )2; A l (OH)3; Cr(OH)3; Sn(OH)2; Pb(OH)2 и др. Перечисленные вещества практически нерастворимы в воде, но способны растворяться как в кислотах, так и в основаниях. При взаимодействии с кислотами амфотерные электролиты проявляют основные свойства, например:
Zn(OH)2 + 2 HCl ⇆ ZnCl2 + 2 H2O, (5.38)
Zn(OH)2 + 2 H+ ⇆ Zn2+ + 2 H2O.
И наоборот, при взаимодействии с основаниями амфотерные электролиты проявляют кислотные свойства, образуя растворимые в воде комплексные соли, например:
Zn(OH)2 + 2 NaOH ⇆ Na2[Zn(OH)4], (5.39)
Zn(OH)2 + 2 OH- ⇆ [Zn(OH)4]2-.
Для определения рН растворов можно использовать так называемые кислотно-основные индикаторы, которые представляют собой слабые органические кислоты и основания, имеющие различную окраску в диссоциированной и молекулярной формах. Так, индикатор фенолфталеин представляет собой слабую органическую кислоту, формулу которой в общем виде можно представить как НИнд. В водном растворе фенолфталеин диссоциирует по схеме:
+ основание
(1) НИнд « Н+ + Инд-
бесцветный малиновый
 причем раствор остается бесцветным, поскольку концентрация окрашенного иона ничтожно мала. При добавлении основания равновесие сильно смещено вправо, т.к. ионы водорода связываются гидроксид-ионами в малодиссоциированные молекулы воды. Поэтому в основной среде раствор фенолфталеина приобретает малиновую окраску.
причем раствор остается бесцветным, поскольку концентрация окрашенного иона ничтожно мала. При добавлении основания равновесие сильно смещено вправо, т.к. ионы водорода связываются гидроксид-ионами в малодиссоциированные молекулы воды. Поэтому в основной среде раствор фенолфталеина приобретает малиновую окраску.
При работе в кислых средах в качестве индикаторов используют слабые органические основания, диссоциирующие по схеме:
(2) Инд ОН « Инд+ + ОН-
окраска I окраска II
+ кислота

Увеличение концентрации ионов водорода (повышение кислотности среды) сдвигает равновесие за счет связывания ионов ОН- и наблюдается изменение цвета раствора.
Лекция №6.
Растворы (продолжение).
План лекции:
1. Произведение растворимости.
2. Законы Рауля.
3. Осмос.
Рассмотрим равновесия, возникающие при растворении или осаждении мало растворимых твердых веществ. Такие реакции являются гетерогенными. Для того чтобы между твердыми веществом и его раствором установилось равновесие, раствор должен быть насыщенным и находится в соприкосновении с нерастворившейся частью твердого вещества. Например:
растворилось L образовалось L образовалось L
BaSO4 (тв) « Ba2+ (водн) + SO  (водн)
(водн)
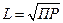
Сульфат бария – ионное соединение – сильный электролит. Такие вещества присутствуют в растворе в виде ионов. Константа равновесия для (60) имеет следующее выражение:
 ,
,
в нем концентрация твердого сульфата бария является постоянной величиной, которую можно перенести в левую часть равенства. Тогда получим новую константу, которая называется произведением растворимости и обозначается либо ПР, либо КL:
ПР(BaSO4) = C(Ba2+)C(SO  ) = L2
) = L2

 , ПР – табличная величина.
, ПР – табличная величина.
Произведение растворимости равно произведению молярных концентраций ионов, участвующих в равновесии, каждая из которых возведена в степень, равную стехиометрическому коэффициенту при соответствующем ионе в уравнении равновесия.
Ca3(PO4)2 (тв.) « 3 Ca2+ (водн) + 2 PO  (водн)
(водн)
ПР =  ; ПР=(3L)3(2L)2=108L5
; ПР=(3L)3(2L)2=108L5

KClO4 (тв) « K+ (водн) + ClO  (водн)
(водн)

Одноименные ионы понижают растворимость, но ПР остается постоянной величиной при Т= const .
Пример: Вычислить растворимость KClO4 в растворе КСl с концентрацией 0,2 моль/л. Концентрации ионов в исходном растворе:
с(К+) = с(Сl-) = 0,2 моль/л.
Допустим, что растворится х моль/л KClO4, тогда
ПР(KClO4) = 29×10-4 = х×(0,2 + х)
х = с(СlO 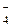 ) х2 + 0,2 х - 29×10-4 = 0
) х2 + 0,2 х - 29×10-4 = 0
(х + 0,2) = с(К+) х = 0,014
Видно, что растворимость перхлората калия (L(KClO4) моль/л) в растворе KCl (с = 0,2 моль/л) уменьшилась в 4 раза.
Значения ПР различных веществ даны в таблицах.
Пример: Если слить вместе растворы растворимых солей BaCl2 и Na2SO4, то осадок BaSO4 выпадет и равновесие установится только при условие, что произведение ионных концентраций Q = c ( Ba 2+ ) c ( SO  ) окажется больше, чем КL(ВаSO4).
) окажется больше, чем КL(ВаSO4).
Между ионным произведением Q и истинным ПР возможны следующие соотношения:
1) при Q > ПР, осаждение продолжается до тех пор, пока Q не станет равным ПР;
2) при Q=ПР, положение равновесия достигнуто (насыщенный раствор);
3) при Q < ПР, твердые вещества растворяются, до Q=ПР.
Растворимость любой соли, анион которой обладает основными свойствами, в какой-то степени зависит от рН. Например, растворение Mg(OH)2 описывается равновесием:
Mg(OH)2 (тв.) « Mg2+ + 2 OH-;
ПР =1,8×10-11, L = 1,65×10-4 (моль/л)
Если растворение Mg(OH)2 проводить в буферном растворе, рН которого 9, то рОН будет 5, а концентрация ОН- будет равна 10-5 (с(ОН-)=10-5)
ПР = с(Mg2+) c2(OH-) = 1,8×10-11, откуда
L(Mg(OH)2) = c(Mg2+) = 1,8×10-11/10-10 = 0,18 (моль/л)
Видно, что в буферном растворе с рН=9 растворимость Mg(OH)2 возрасла на три порядка. Если бы раствор был кислым, то растворимость Mg(OH)2 была бы еще выше за счет связывания OH- - ионов протонами в молекулы воды.
Значительное изменение кислотности или основности раствора оказывает влияние на растворимость почти всех солей. В большей степени это влияние заметно в тех случаях когда один или оба иона соли обладают достаточно сильными кислотными или основными свойствами.
Законы Рауля отражают коллигативные свойства растворов, то есть такие, которые зависят только от концентрации частиц растворенного вещества, а не от его состава. Законы Рауля применимы для разбавленных растворов нелетучих веществ.
Рассмотрим две системы:
1. Чистый растворитель и находящийся с ним в равновесии насыщенный пар растворителя, давление которого обозначим P0;
2. Раствор неэлектролита и находящийся с ним в равновесии насыщенный пар растворителя, давление которого обозначим P.
Давление насыщенного пара растворителя над раствором всегда меньше давления насыщенного пара растворителя над чистым растворителем, т.к. при растворении вещества концентрация частиц растворителя в растворе уменьшается и динамическое равновесие между раствором и насыщенным паром растворителя смещается в сторону раствора.
Согласно первому закону Рауля давление насыщенного пара растворителя над раствором пропорционально мольной доле растворенного вещества:
P=P0х0; x0=n0/(n0+n1)
где P-давление насыщенного пара растворителя над раствором,
P0-давление насыщенного пара над чистым растворителем
х0-мольная доля растворенного вещества в растворе
n1-количество растворенного компонента
Учитывая, что х1=1-х, получим
(P0-P)/р0=х1, где х1= n1/(n0+n1)- мольная доля растворенного компонента.
По второму закону Рауля повышение температуры кипения раствора  и понижение температуры замерзания (кристаллизация)
и понижение температуры замерзания (кристаллизация) 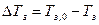 пропорционально моляльной концентрации растворенного вещества.
пропорционально моляльной концентрации растворенного вещества.

где  - моляльная концентрация растворенного вещества в моль/кг,
- моляльная концентрация растворенного вещества в моль/кг,  -количество растворенного вещества в моль ,
-количество растворенного вещества в моль ,  -масса растворителя в кг,
-масса растворителя в кг, 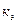 и
и  -эбулиоскопическая и криоскопическая постоянная, характеризующие природу растворителя.
-эбулиоскопическая и криоскопическая постоянная, характеризующие природу растворителя.
Осмотическое давление.
Осмосом называется самопроизвольный переход молекул растворителя через полупроницаемую мембрану, разделяющую растворитель и раствор или два раствора с разной концентрацией. При этом молекулы растворителя переходят из менее концентрированного раствора в более концентрированный. Давление, которое необходимо создать для предотвращения осмоса, называется осмотическим. Вант-Гофф, примерив для расчета осмотического давления уравнение состояния идеального газа, выел формулу расчета осмотического давление
πV=nRT
π=n/V RT
π=c1RT
где π-осмотическое давление в Па,М – объем раствора в м3, n1 – количество растворенного вещества в моль, Т – температура в К, R-универсальная газовая постоянная, c1 – молярная концентрация в моль/ м3
Осмос играет важную роль в биологических процессах, т.к. стенки клеток являются полупроницаемыми мембранами, пропускающими молекулы растворенных в ней веществ.
Законы Рауля и осмос в растворах электролитов.
Рассчитать по законам Рауля температуры кипения и замерзания и вычисленное по уравнению состояния идеального газа соответствуют экспериментально определенным только для разбавленных растворов неэлектролитов. В растворах электролитов вычисленные величины значительно отличались от определенных экспериментально
. Поэтому Вант-Гофф ввел поправочный коэффициент i, названный изотоническим. Он учитывает увеличение количества частиц растворенного вещества в растворе электролита за счет процесса диссоциации. Его величина зависит от степени диссоциации  и количества ионов образующихся при распаде молекулы
и количества ионов образующихся при распаде молекулы  и может быть рассчитан по формуле
и может быть рассчитан по формуле
i=1+  (
(  -1)
-1)
Подставляя изотонический коэффициент в уравнение расчета осмотического давления и законы Рауля, получаем:
(P0-P)/P0=ix1

|
из
5.00
|
Обсуждение в статье: Растворы (продолжение). |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

