 |
Главная |
Способы получения оксидов
|
из
5.00
|
Классы неорганических веществ
Оксиды
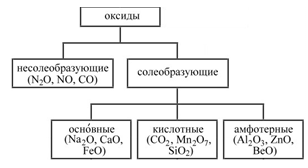 Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления "–2".
Оксиды — это сложные вещества, состоящие из двух элементов, один из которых кислород в степени окисления "–2".
Несолеобразующие — это оксиды, которые при реакции с кислотами или щелочами не образуют солей.
Основные — это оксиды металлов со степенью окисления +1, +2 (за исключением амфотерных), которым соответствуют гидроксиды — основания. Например: CuO ® Cu(OH)2.
Кислотные — это оксиды неметаллов или металлов с высшей степенью окисления (от +5), которым соответствуют гидроксиды — кислоты. Например: SO3 ® H2SO4; Mn2O7 ® HMnO4.
Амфотерные — это оксиды амфотерных элементов, которые в зависимости от условий проявляют основные или кислотные свойства. Например: ZnO ® H2ZnO2 ® Zn(OH)2.
Способы получения оксидов
1. Окисление простых и сложных веществ. а) 2Mg + O2 = 2MgO; б) C + O2 = CO2 в) 2ZnS + 3O2 = 2ZnO + 2SO2
2. Разложение нерастворимых оснований, некоторых кислот и солей.
t t t
а) Cu(OH)2 = CuO + H2O; б) H2SiO3 = SiO2 +H2O; в) CaCO3 = CaO + CO2
Химические свойства основных оксидов
| Схема реакции | Пример | |
| 1 | О.оксид + кислота = соль + вода | CuO + 2HCl = CuCl2 + H2O |
| 2 | О. оксид + к. оксид = соль О. оксид + амфотерный оксид = соль | Na2O + SO3 = Na2SO4 K2O + ZnO = K2ZnO2 |
| 3 | Оксиды химически активных металлов + вода = щелочь | BaO + H2O = Ba(OH)2 |
| 4 | Оксиды малоактивных металлов реагируют с восстановителями: А) H2 Б) C В) более активные металлы Г) сложными веществами ( NH 3 , CO ) | А) WO3 + 3H2 = W + 3H2O Б) FeO + C = Fe + CO В) Cr2O3 + 2Al = Al2O3 + 2Cr Г) CuO + 2 NН3 = 3Cu + N2 + 3 H2O FeO + CO = Fe + CO2 |
Химические свойства кислотных оксидов
| Схема реакции | Пример | |
| 1 | К. оксид + вода = кислота (искл. – SiO 2 ) | SO3 + H2O = H2SO4 |
| 2 | К. оксид + щелочь = соль + вода | 2NaOH + CO2 = Na2CO3 + H2O |
| 3 | К. оксид + о. оксид = соль К. оксид + амфотерный оксид = соль | CO2 + CaO = CaCO3 SO3 + ZnO = ZnSO4 |
| 4 | Менее летучие оксиды вытесняют более летучие из солей | CaSO3 + SiO2 = CaSiO3 + SO2 |
Химические свойства амфотерных оксидов
| Схема реакции | Пример | |
| 1 | Амф . оксид + о.оксид = соль Амф . оксид + к. оксид = соль | Na2O + Al2O3 = 2NaAlO2 SO3 + BeO = BeSO4 |
| 2 | Амф . оксид + кислота = соль + вода | Al2O3 + 6HCl = 2AlCl3 + 3H2O |
| 3 | Амф . оксид + щелочь = соль А) при сплавлении: МеО + 2 NaOH = Na 2 MeO 2 + H 2 O Me2O3 + 2NaOH = 2NaMeO2 + H2O Б) с концентрированными растворами: МеО + 2NaOH + H2O= Na2[Me(OH)4] Me2O3 + 2NaOH + H2O= 2Na[Me(OH)4] | ZnO + NaOHтв. = ZnO + NaOH + H2O = Al2O3 + NaOHтв = Al2O3 + NaOH + H2O = BeO + NaOHТВ = BeO + NaOH + H2O = Cr2O3 + NaOHти = Cr2O3 + NaOH + H2O = |
 Основания
Основания
 Основания — это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид–ионы Me(OH)x Mex+ + xOH–
Основания — это электролиты, при диссоциации которых в качестве анионов образуются только гидроксид–ионы Me(OH)x Mex+ + xOH–
Способы получения
I . Щелочей (растворимых оснований)
1. Взаимодействие химически активных металлов и их оксидов с водой.
а) 2Na + H2O = 2NaOH + H2; б) CaO + H2O = Ca(OH)2
2. Электролиз водных растворов солей щелочных металлов.
2KCl + 2H2O  2KOH + H2↑ + Cl2↑
2KOH + H2↑ + Cl2↑
II . Нерастворимых оснований
Взаимодействие щелочей с растворами солей:
2NaOH + CuCl2 = Cu(OH)2↓ + 2NaCl
Химические свойства щелочей
| Схема реакции | Пример | |
| 1 | Диссоциируют , изменяют окраску индикаторов лакмус: фиолетовый →синий; метилоранж: оранжевый→желтый; фенолфталеин: бесцв. → малиновый. | NaOH Na+ + OH– |
| 2 | Щелочь + кислота = соль + вода (реакция нейтрализации) | KOH + HCl = KCl + H2O |
| 3 | Щелочь + к. оксид = соль + вода | 6NaOH + P2O5 = |
| 4 | Щелочь + соль = соль1 + основание (↓, ↑) | Ba(OH)2 + ZnCl2 = BaCl2 + Zn(OH)2¯ 2KOH + (NH4)2SO4 = K2SO4 + 2NH3 + 2H2O |
| 5 | Щелочь + металл (амф) = соль + Н2 ↑ | Zn + 2NaOH + 2H2O = Na2[Zn(OH)4] + H2↑ 2Al + 2 NaOH + 6H2O = 2 Na[Al(OH)4] + 3H2↑ |
Химические свойства нерастворимых оснований
1. Реагируют с растворами кислот, образуя соль и воду: Cu(OH)2 + H2SO4 = CuSO4 + 2H2O
t
2. При нагревании разлагаются: Fe(OH)2 = FeO + H2O
Химические свойства амфотерных гидроксидов
- Взаимодействуют с кислотами.
- Взаимодействуют со щелочами
А) сплавление с твердыми щелочами Zn(OH)2 + 2 NaOHТВ = Na2ZnO2 + 2H2O; Al(OH)3 + NaOHТВ = NaAlO2 + 2H2O
Б) с растворами щелочей Zn(OH)2 + 2NaOH = Na2[Zn(OH)4]; Al(OH)3 + NaOH = Na[Al(OH)4]
Be(OH)2 + NaOHТВ = Cr(OH)3 + NaOH ТВ =
Be(OH)2 + NaOH = Cr(OH)3 + NaOH =
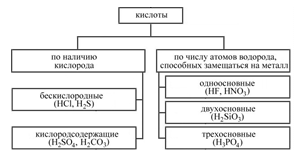
Кислоты
Кислоты — это электролиты, при диссоциации которых в качестве катионов образуются только катионы водорода:
 НxAc хH+ + Acx–
НxAc хH+ + Acx–
Способы получения
1. Бескислородные кислоты : H2 + неме
а) H2 + Cl2 = 2HCl; б) H2 + S = H2S
2. Кислородсодержащие: к.оксид + вода (искл. SiО2).
а) SO3 + H2O = H2SO4; б) N2O5 + H2O = 2HNO3
3. Соль + сильная кислота а) Na2S + 2HCl = 2NaCl + H2S; б) K2SiO3 + H2SO4 = K2SO4 + H2SiO3¯
Химические свойства кислот.
| Схема реакции | Пример | |
| 1 | Диссоциируют , изменяют окраску индикаторов лакмус: фиолетовый → красный; метилоранж: оранжевый→ розовый; фенолфталеин: бесцв. | HNO3 H+ + NO3– |
| 2 | Кислота + металл (до H ) = соль + Н2 H 2 SO 4 (конц) и HNO 3 любой концентрации с металлами проявляют свойства сильных окислителей, образуя различные продукты, (но никогда не образуя водород!!! | Zn + 2HCl = ZnCl2 + H2↑ |
| 3 | Кислота + основание = соль + вода Кислота + амф. гидроксид = соль + вода | H2SO4 + Ca(OH)2 = CaSO4 + 2H2O 3HCl + Al(OH)3 = AlCl3 + 3H2O |
| 4 | Кислота + о. оксид = соль + вода Кислота + амф. оксид = соль = вода | 2HCl + MgO = MgCl2 + H2O 2HNO3 + ZnO = Zn(NO3)2 + H2O |
| 5 | Кислота + соль = соль1 + кислота 1 (↑, ↓, слабый электролит) | H2SO4 + BaCl2 = BaSO4¯ + 2HCl
K2CO3 + 2HCl  2KCl + H2O + CO2
HCl + KNO2 = KCl + HNO2 2KCl + H2O + CO2
HCl + KNO2 = KCl + HNO2
|
| 6 | Кислота + NH 3 = соль аммония | HNO3 + NH3 = NH4NO3 |
| 7 | Некоторые кислоты разлагаются Кислота = вода + к. оксид | H2CO3 = CO2 + H2O. |
Соли
 Средние соли (МеАс) – это электролиты, диссоциирующие на катионы металлов (или аммония) и анионы кислотных остатков. MexAcy хMey+ + уAcx–
Средние соли (МеАс) – это электролиты, диссоциирующие на катионы металлов (или аммония) и анионы кислотных остатков. MexAcy хMey+ + уAcx–
название название название ст. ок.
|
из
5.00
|
Обсуждение в статье: Способы получения оксидов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

