 |
Главная |
Образец оформления лабораторной работы
|
из
5.00
|
ХИМИЯ
Лечебное дело, педиатрия
ТЕМА 5. ЛИГАНДООБМЕННЫЕ ПРОЦЕССЫ И РАВНОВЕСИЯ
В БИОЛОГИЧЕСКИХ СИСТЕМАХ.
Программа
7. Реакции комплексообразования.
7.1. Координационная теория Вернера.
7.2. Природа химической связи в комплексных соединениях.
7.3. Классификация комплексных соединений.
7.4. Номенклатура комплексных соединений.
7.5. Полидентатные лиганды. Хелатирование. Строение гемоглобина, хлорофилла.
7.6. Устойчивость комплексных соединений в растворах. Константа нестойкости комплекса.
7.7. Токсическое действие солей тяжелых металлов. Антидоты.
Основная литература
1. Юшкова Е.И., Саушкина Е.А. Теоретические основы химии: учебно-методическое пособие. Орел: ОГУ имени И.С. Тургенева, 2017. С. 82 - 91.
2. Ершов Ю.А., Попков В.А., Берлянд А.С., Книжник А.3. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для студентов медицинских специальностей высших учебных заведений. М.: Высшая школа, 2010.
3. Общая химия. Под ред. В.А. Попкова. - М.: ГЭОТАР-Медиа, 2014 - 400 с.
В.И. Слесарев «Химия», «Основы химии живого» -СПб Химиздат, 2000г.
Тестовые задания по химии. Учебно-методическое пособие для самостоятельной работы студентов специальностей Лечебное дело, Педиатрия, Стоматология. /сост. Е.И. Юшкова, Е.А. Саушкина. - Орел, Орловский государственный университет, 2017. – С. 18-20.
Дополнительная литература
1. Третьяков Ю.Д., Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. Неорганическая химия. Химия элементов: Учебник для вузов. В 2 книгах. М., Химия, 2010.
2. Лидин Р.А., Молочко В.А., Андреева Л.Л. Неорганическая химия в реакциях. Справочник. 2-е изд., перераб. и доп. - М.: Дрофа, 2007 - 637 с.
3. Саушкина Е.А., Друшляк Н.Г. Окислительно-восстановительные реакции. Учебно-методическое пособие по курсу общей и неорганической химии. Орел, полиграфическая фирма «Картуш», 2014. – 56 с.
4. Юшкова Е.И., Саушкина Е.А., Королева И.П. Методическое руководство к практикуму по общей химии. – Орел: Изд-во ОРАГС, 2006. 2-е издание – 180 с.
5. Саушкина Е.А., Юшкова Е.И., Королева И.П. Химические элементы. Часть 1. s-элементы. Орел, 2008. – 113 с.
ЗАДАНИЕ № 5 ПО ТЕМЕ
«ЛИГАНДООБМЕННЫЕ ПРОЦЕССЫ И РАВНОВЕСИЯ В БИОЛОГИЧЕСКИХ СИСТЕМАХ»
I.Вопросы для самоподготовки
П.п. 7.1-7.7 программы изучить (ИМЕТЬ КОНСПЕКТ В ЛЕКЦИОННОЙ ТЕТРАДИ).
II. Выполнить тестовые задания п. 2.6. (Тестовые задания по химии. Учебно-методическое пособие для самостоятельной работы студентов специальностей Лечебное дело, Педиатрия, Стоматология. /сост. Е.И. Юшкова, Е.А. Саушкина. - Орел, Орловский государственный университет, 2017. – С.18-20) электронная версия
III.Решить задачи:
1. Какая масса 15% раствора аммиака требуется для растворения 10 г гидроксида меди?
2. Вычислите концентрацию ионов ртути в 0,05 М растворе тетрахлоромеркурата (II) калия, если константа нестойкости комплексного иона равна 6·10-7.
3. Для указанных комплексных соединений определите:
а) заряд внутренней сферы;
б) степень окисления центрального атома;
в) координационное число центрального атома;
г) заряд лигандов;
д) дайте названия; [Ag(NH3)2]NО3, K2[Zn(OH)4], [Сu(NН3)4]SO4.
IV. Подготовить конспект (в лекционной тетради) «Характеристика биогенных элементов» (Элементы Н, Na, K, Ca). План характеристики взять из лекции № 8 «Биогенные элементы».
V. Подготовиться к Лабораторной работе "Лигандообменные процссы и равновесия. Конкурирующие (совмещенные) равновесия"
Приложение
Примеры решения задач
Задача № 1. Рассчитать концентрацию ионов – комплексообразователя в 1 л раствора хлорида диамминсеребра (I) с концентрацией 0,01 моль/л. Kнест.([Ag(NH3)2]+) = 9,3 ⋅ 10-8.
Алгоритм решения:
1 Запишите уравнение реакции диссоциации комплексного соединения в водном растворе.
2 Запишите уравнение диссоциации комплексного иона.
3 Запишите выражение для Кнест. комплексного иона.
4 Выразите концентрацию, продиссоциированного комплексного иона через Х.
5 Выразите концентрацию ионов, в состоянии равновесия.
6 Решить задачу. Рассчитайте [Ag+], подставив в нее соответствующие величины.
| Дано: С ([Ag(NH3)]) = 0,01 моль/л, Kнест.([Ag(NH3)2]+) = 9,3 ⋅ 10-8 _____________________________ [Ag]+ = ? | Решение.
1. [Аg(NН3)2]С1 → [Ag(NH3)2]+ + С1-
2. [Ag(NH3)2]+↔ Ag+ + 2NН3,
3. Kнест.([Ag(NH3)2]+) = 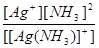 ,
4. С([Ag(NH3)2]+)дисс. = х моль,
5. равновесные концентрации:
[Ag+] = х моль, [NH3] = 2 х моль,
[Ag(NH3)2]+. = (0,01 – х) моль, т.к х – мало, [Ag(NH3)2]+. = 0,01 моль,
6. 9,3 ⋅ 10-7= ,
4. С([Ag(NH3)2]+)дисс. = х моль,
5. равновесные концентрации:
[Ag+] = х моль, [NH3] = 2 х моль,
[Ag(NH3)2]+. = (0,01 – х) моль, т.к х – мало, [Ag(NH3)2]+. = 0,01 моль,
6. 9,3 ⋅ 10-7= 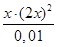 = = 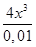 ; ;
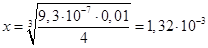 моль/л.
Ответ: 1,32 ⋅ 10-3 моль/л. моль/л.
Ответ: 1,32 ⋅ 10-3 моль/л.
|
ЛАБОРАТОРНАЯ РАБОТА № 5
(учебно-исследовательская)
Лигандообменные процссы и равновесия. Конкурирующие (совмещенные) равновесия
Цель работы: Экспериментально наблюдать конкурирующий характер химических реакций.
Оборудование: набор пробирок в штативе, капельницы с растворами, пипетки глазные.
Реактивы: кобальта хлорид (конц. р-р), соляная кислота (конц. р-р), железа хлорид (III) (0,5 н), калия фторид (0,5 н), калия тиоцианат (0,01 н), серебра нитрат (0,05 н), натрия хлорид (0,5 н), аммиак (конц. р-р), азотная кислота (2 н), вода дистиллированная.
ВЫПОЛНЕНИЕ ЭКСПЕРИМЕНТА
Опыт 1. Замена лигандов в комплексах
В пробирку налейте 0,5-1 мл раствора хлорида кобальта. Отметьте цвет раствора. Добавьте по каплям концентрированный раствор соляной кислоты. Что наблюдаете? Почему изменилась окраска раствора? Разбавьте водой. Что произошло?
Запишите схемы происходящих химических реакций, если комплексы кобальта имеют следующее строение: [Co(H2O)6]2+← HCl (H2O) → [CoCl4]2-
аквакомплекс Co(II) ацидокомолекс Со(П)
Сделайте рисунок, сформулируйте вывод.
Опыт 2. Конкурирующие лигандообменные процессы
В две пробирки налейте по1 мл раствора FеCl3, затем по каплям раствор калия тиоцианата (KCNS). Отметьте признаки реакции. Запишите уравнение реакции, если образующийся тиоцианатный комплекс железа имеет следующее строение [Fе(SСN)6]3-.
Одну пробирку оставьте в качестве контроля. В другую добавьте раствор калия фторида. Что наблюдаете? Запишите уравнение реакции, если образующийся фторидный комплекс железа имеет следующее строение [FеF6]3-.
Пользуясь справочными таблицами, сравните константы нестойкости комплексов Fe(III). Сделайте рисунки.
Сформулируйте вывод.
Опыт 3. Конкурирующие лигандообменные и гетерогенные процессы
В пробирку налейте 5-6 капель раствора нитрата серебра, добавьте по каплям раствор хлорида натрия. Что наблюдаете?
К образовавшемуся осадку добавьте несколько капель раствора аммиака до полного растворения. Напишите уравнения происходящих химических реакций, если образующийся аммиачный комплекс серебра имеет следующее строение [Ag(NH3)2]-.
Для разрушения полученного аммиачного комплекса серебра добавьте по каплям раствор азотной кислоты. Что наблюдаете? Что свидетельствует о разрушении комплекса? Напишите уравнение реакции. Сделайте рисунки.
Сформулируйте вывод.
Образец оформления лабораторной работы
Дата "____" ___________20__г.
Лабораторная работа № 5
Лигандообменные процссы и равновесия. Конкурирующие (совмещенные) равновесия
Цель работы: Экспериментально наблюдать конкурирующий характер химических реакций.
Оборудование: набор пробирок в штативе, капельницы с растворами, пипетки.
Реактивы: кобальта хлорид (конц. р-р), соляная кислота (конц. р-р), железа хлорид (III) (0,5 н), калия фторид (0,5 н), калия тиоцианат (0,01 н), серебра нитрат (0,05 н), натрия хлорид (0,5 н), аммиак (конц. р-р), азотная кислота (2 н), вода дистиллированная.
Опыт 1. Замена лигандов в комплексах
| Добавленный реагент | Наблюдения, рисунки | Уравнение реакции |
| CoCl3 | 
| |
| HCl | 
| |
| H2O | 
|
Сформулируйте вывод.
Опыт 2. Конкурирующие лигандообменные процессы
| Добавленный реагент | Наблюдения, рисунки | Уравнение реакции | Константы нестойкости комплексов |
| FеCl3 + KCNS | 
| Ks[Fе(SСN)6]3-= | |
| FеCl3+KCNS + KF | 
| Ks[FеF6]3-= |
Сформулируйте вывод.
Опыт 3. Конкурирующие лигандообменные и гетерогенные процессы
| Добавленный реагент | Наблюдения, рисунки | Уравнение реакции |
| AgNO3 + NaCl | 
| |
| Осадок + NH3 | 
| |
| Раствор + HNO3 | 
|
Сформулируйте вывод.
|
из
5.00
|
Обсуждение в статье: Образец оформления лабораторной работы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

