 |
Главная |
Выполнение эксперимента.
|
из
5.00
|
ХИМИЯ
Лечебное дело, педиатрия
ТЕМА 7. КОЛЛОИДНАЯ ХИМИЯ
Программа
Физико-химия поверхностных явлений в функционировании живых систем
9.1. Адсорбционные равновесия и процессы на подвижных границах раздела фаз.
9. 2. Поверхностная энергия Гиббса и поверхностное натяжение.
9.3. Адсорбция. Уравнение Гиббса.
9.4. Изотерма адсорбции.
9.5. Поверхностно активные и поверхностно не активные вещества.
9.6. Изменение поверхностной активности в гомологических рядах (правило Траубе).
9.7. Ориентация молекул в поверхностном слое и структура биомембран.
9.8. Адсорбционные равновесия на неподвижных границах раздела фаз.
9.9. Физическая адсорбция и хемосорбция.
9.10. Адсорбция газов на твердых телах.
9.11. Зависимость величины адсорбции от разных факторов.
9.12. Адсорбция из растворов.
9.13. Уравнение Ленгмюра.
9.14. Правило выравнивания полярностей. Избирательная адсорбция.
9.15. Значение адсорбционных процессов для жизнедеятельности. Физико-химические основы адсорбционной терапии, гемосорбции, применения в медицине ионитов
Физическая химия дисперсных систем
10.1. Классификация дисперсных систем (по степени дисперсности, по агрегатному состоянию фаз, по силе межмолекулярного взаимодействия между дисперсной фазой и дисперсионной средой). Природа коллоидного состояния.
10.2. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов. Очистка коллоидных растворов (диализ, электродиализ, ультрофильтрация). Физико-химические принципы функционирования искусственной почки.
10.3. Молекулярно-кинетические свойства коллоидных растворов: броуновское движение, диффузия, осмотическое давление, седиментационное равновесие.
10.4. Оптические свойства: рассеивание света.
10.5. Электрокинетические свойства коллоидных растворов: электрофорез и электроосмос. Электрокинетический потенциал и его зависимость от различных факторов.
10.6. Строение коллоидных частиц. Изоэлектрическое состояние.
10.7. Устойчивость дисперсных систем. Факторы влияющие на устойчивость лиозолей. Коагуляция. Порог коагуляции. Явление привыкания. Взаимная коагуляция. Коллоидная защита и пептизация.
10.9. Коллоидные ПАВ. Биологическки важные коллоидные ПАВ (мыла, тетергенты, желчные кислоты). Мицелообразование в растворах ПАВ. Липосомы.
10.10. Медико-биологическое значение дисперсных систем.
Основная литература
1. Юшкова Е.И., Саушкина Е.А. Теоретические основы химии: учебно-методическое пособие. Орел: ОГУ имени И.С. Тургенева, 2017. С. 91 - 111.
2. Ершов Ю.А., Попков В.А., Берлянд А.С., Книжник А.3. Общая химия. Биофизическая химия. Химия биогенных элементов: Учебник для студентов медицинских специальностей высших учебных заведений. М.: Высшая школа, 2010.
3. Общая химия. Под ред. В.А. Попкова. - М.: ГЭОТАР-Медиа, 2014 - 400 с.
В.И. Слесарев «Химия», «Основы химии живого» - СПб Химиздат, 2000г.
Тестовые задания по химии. Учебно-методическое пособие для самостоятельной работы студентов специальностей Лечебное дело, Педиатрия, Стоматология. /сост. Е.И. Юшкова, Е.А. Саушкина. - Орел, Орловский государственный университет, 2017. – С. 29-35.
Дополнительная литература
1. Третьяков Ю.Д., Л.И. Мартыненко, А.Н. Григорьев, А.Ю. Цивадзе. Неорганическая химия. Химия элементов: Учебник для вузов. В 2 книгах. М., Химия, 2010.
2. Лидин Р.А., Молочко В.А., Андреева Л.Л. Неорганическая химия в реакциях. Справочник. 2-е изд., перераб. и доп. - М.: Дрофа, 2007 - 637 с.
3. Саушкина Е.А., Друшляк Н.Г. Окислительно-восстановительные реакции. Учебно-методическое пособие по курсу общей и неорганической химии. Орел, полиграфическая фирма «Картуш», 2014. – 56 с.
4. Юшкова Е.И., Саушкина Е.А., Королева И.П. Методическое руководство к практикуму по общей химии. – Орел: Изд-во ОРАГС, 2006. 2-е издание – 180 с.
5. Саушкина Е.А., Юшкова Е.И., Королева И.П. Химические элементы. Часть 1. s-элементы. Орел, 2008. – 113 с.
ЗАДАНИЕ № 7 ПО ТЕМЕ
«КОЛЛОИДНАЯ ХИМИЯ»
I. Вопросы для самоподготовки
П.п. 9.1-9.15, П.п. 10.1-10.10 программы (ИМЕТЬ КОНСПЕКТ В ЛЕКЦИОННОЙ ТЕТРАДИ).
II. Выполнить тестовые задания п. 2.5. (Тестовые задания по химии. Учебно-методическое пособие для самостоятельной работы студентов специальностей Лечебное дело, Педиатрия, Стоматология / сост. Е.И. Юшкова, Е.А. Саушкина. - Орел, Орловский государственный университет, 2017. – С. 29-35.) электронная версия
III.Решить задачи:
1. Поверхностное натяжение водного раствора поверхностно-активного вещества с концентрацией 0,065моль/л при 293 К равно 5,13⋅ 10-2 Н/м. Вычислите адсорбцию этого вещества из раствора с концентрацией 0,038 моль/л.
2. К 50 мл уксусной кислоты при 20˚С добавили 1,5 г угля. Концентрацию кислоты (моль/л) до и после адсорбции определяли титрованием 10 мл ее 0,1 М раствором натрия гидроксида. Данные титрования: объем натрия гидроксида, пошедшего на титрование кислоты до адсорбции 1,1 мл, после адсорбции -0,23 мл. Определите величину удельной адсорбции (моль/г).
3. В раствор объемом 60 мл некоторого вещества с концентрацией 0,44 моль/л поместили твердый адсорбент массой 3 г. После достижения адсорбционного равновесия концентрация вещества снизилась до 0, 350 моль/л. Вычислите величину адсорбции.
4. Напишите формулу мицеллы золя иодида серебра, полученного добавлением 30 мл раствора нитрата серебра с концентрацией 0,02 моль/л к 50 мл раствора иодида калия с концентрацией 0,001 моль/л. Каким методом получен золь?
5. Коагуляция 10 мл гидрозоля гидроксида железа (Ш) наступила при добавлении к нему 2 мл раствора сульфата натрия с молярной концентрацией 0,0025 моль/л. Вычислите порог коагуляции и коагулирующую способность этого электролита.
6. Какой объем дихромата калия с концентрацией 0,01 моль/л можно добавить к 1 л золя, чтобы вызвать его коагуляцию, если известно, что порог коагуляции равен 0,6 моль/л?
IV. Подготовить конспект (в лекционной тетради) «Характеристика биогенных элементов» План характеристики взять из лекции № 8 «Биогенные элементы».
V. Лабораторная работа "Адсорбция на поверхности твердого тела" (ПОДГОТОВИТЬ МАКЕТ ЛАБОРАТОРНОЙ РАБОТЫ В ТЕТРАДИ ДЛЯ ЛАБОРАТОРНЫХ РАБОТ)
Примеры решения задач
Задача № 1.
Поверхностное натяжение водного раствора содержащего ПАВ в концентрации 0,056 моль/л, при 293 К равно 4,33·10-2 Н/м. Вычислите величину адсорбции ПАВ из раствора с концентрацией 0,028 моль/л при 293 К.
| Дано: ΔС = 0,056 моль/л С = 0,028 моль/л Т = 293 К σ = 4,33·10-2 Н/м σ (Н2О) = 7,28·10-2 Н/м (справочная величина) _____________________ Г - ? | Решение:
Величину адсорбции вычисляют по уравнению Гиббса:
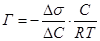 , считая что ΔС = 0,056 моль/л, а
Δσ = σ(раствора) - σ(Н2О) = 4,33·10-2 - 7,28·10-2 = - 2,95·10-2 (Н/м)
Г = (- 2,95·10-2)/0,056· (- 0,028)/(8,31· 293) = 6,06·10-6 моль/м2
Ответ: Г = 6,06·10-6 моль/м2 , считая что ΔС = 0,056 моль/л, а
Δσ = σ(раствора) - σ(Н2О) = 4,33·10-2 - 7,28·10-2 = - 2,95·10-2 (Н/м)
Г = (- 2,95·10-2)/0,056· (- 0,028)/(8,31· 293) = 6,06·10-6 моль/м2
Ответ: Г = 6,06·10-6 моль/м2
|
Задача № 2.
В 50 мл раствора с концентрацией уксусной кислоты 0,1 моль/л поместили адсорбент массой 2 г и взболтали смесь до достижения адсорбционного равновесия. После этого раствор отфильтровали. На титрование 10 мл фильтрата пошло 15 мл раствора титранта с концентрацией КОН, равной 0,05 моль/л. Определите величину адсорбции уксусной кислоты.
| Дано: V(раствора) = 50 мл = 0,005 л С(CH3COOH)=0,1 моль/л m (угля) = 2 г V(фильтрата) = 10 мл V(КOH) = 15 мл С(КOH) = 0,05 моль/л. _____________________ Г - ? | Решение:
1. По результатам титрования находим равновесную концентрацию уксусной кислоты (после адсорбции)
С(CH3COOH) = С(КOH) ·V(КOH) / V(фильтрата CH3COOH) =
= (0,05·15) / 10 = 0,075 (моль/л)
2. определяем адсорбцию по разности концентраций исходного и равновесного растворов уксусной кислоты (адсорбата):
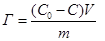 Г = (0,1 - 0,075) · 0,005 / 2 = 6,2510-4 моль/г
Ответ: Г = 6,2510-4 моль/г
Г = (0,1 - 0,075) · 0,005 / 2 = 6,2510-4 моль/г
Ответ: Г = 6,2510-4 моль/г
|
Задача № 3.
Золь бромида серебра получен смешиванием 40 мл раствора нитрата серебра с концентрацией 0,004 моль/л и 10 мл раствора бромида калия с концентрацией 0,008 моль/л. Приведите схему строения мицеллы золя бромида серебра.
| Дано: C (AgNO3) = 0,004 моль/л V(AgNO3) = 40 мл C (KBr) = 0,008 моль/л V(KBr) = 10 мл _____________________ Схема строения мицеллы золя бромида серебра - ? | Решение. 1) Определим количества веществ, использованных для приготовления золя: n (AgNO3) =C · V= 0,004 моль/л · 0,04 л = 0,00016 моль n(KBr) =C · V= 0,008 моль/л · 0,01 л = 0,00008 моль Сравнение этих количеств показывает, что нитрат серебра взят в избытке. Следовательно, в соответствии с правилом Панета - Фаянса на кристаллах бромида серебра AgBr (агрегат) будут адсорбироваться преимущественно катионы серебра Ag+ (потенциалопределяющие ионы), которые вместе с AgBr составят ядро коллоидной частицы. Их заряд будут компенсировать нитрат-анионы NO3−. Часть из них, плотно окружая ядро ("связанные" противоионы) составит вместе с ядром положительно заряженную гранулу; другая часть ("свободные" противоионы) составит диффузный слой. Строение мицеллы можно представить следующим образом: [mAgBr · nAg+· (n - x)NO3-]х+·xNO3- |
Задача 4.
Коагуляция 10 мл гидрозоля железа (III) наступила при добавлении к нему 2 мл раствора сульфата натрия с молярной концентрацией 1,25 ммоль/л. Вычислите порог коагуляции и коагулирующую способность электролита.
| Дано: V(Fe(OH)3) = 10 мл C (Na2SO4) = 1,25 ммоль/л V(Na2SO4) = 2 мл _______________________ C пор. -? | Решение:
Для расчета порога коагуляции воспользуемся формулой:
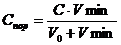 ,
Применительно к данной задаче ,
Применительно к данной задаче
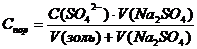 ;
Где С(SO42-) = C(Na2SO42-) = 1,25 ммоль/л = 1,25·10-3моль/л ;
Где С(SO42-) = C(Na2SO42-) = 1,25 ммоль/л = 1,25·10-3моль/л
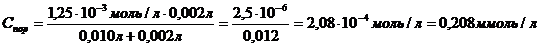 Величину коагулирующей способности вычисляют по формуле: Величину коагулирующей способности вычисляют по формуле:
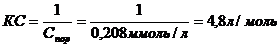 Ответ:С пор= 0,208 ммоль/л, КС = 4,8 л/моль
Ответ:С пор= 0,208 ммоль/л, КС = 4,8 л/моль
|
Задача 5.
Рассчитайте количество (мл) хлорида бария с концентрацией 0,1М, вызывающего коагуляцию 1000 мл золя берлинской лазури, если величина порога коагуляции составила 2,6×10-2 моль/л.
| Дано: C (BaCl2) = 0,1 моль/л V(золя) = 1000 мл γ = 2,6×10-2 моль/л. _____________________ V(BaCl2) - ? | Решение:
1. Порог коагуляции рассчитывается так:
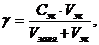 находим объем электролита, исходя из следующих соотношений:
находим объем электролита, исходя из следующих соотношений:
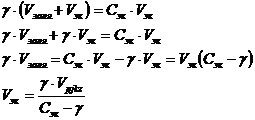 Тогда
Тогда
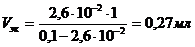 Ответ: V(BaCl2)= 0,27 мл
Ответ: V(BaCl2)= 0,27 мл
|
Приложение
Лабораторная работа
"Адсорбция на поверхности твердого тела"
Цель работы: научиться количественно измерять адсорбцию из растворов на твердых адсорбентах.
Оборудование: бюретка вместимостью 25 мл, конические колбы вместимостью 500 мл, воронки, цилиндры мерные, колбы для титрования, фильтровальная бумага.
Реактивы: уголь активированный, растворы уксусной кислоты четырех разных концентраций (от 50 до 400 ммоль/л), раствор натрия гидроксида титрованный, с концентрацией около 0,1 моль/л, раствор фенолфталеина в этаноле (индикатор).
Выполнение эксперимента.
С помощью мерных цилиндров в четыре сухие пронумерованные колбы наливают по 50 мл раствора уксусной кислоты следующих концентраций: 50 ммоль/л; 100 ммоль/л; 200 ммоль/л; 400 ммоль/л. В каждую колбу вносят одновременно по 1,0 г предварительно измельченного активированного угля. Содержимое колб перемешивают круговыми движениями в течение 20 мин, после чего фильтруют через сухие складчатые фильтры. Первую порцию фильтра объемом 5 мл в каждом случае отбрасывают. Из каждого фильтрата пипеткой отбирают пробу для титрования (объем пробы для каждого из растворов указан в таблице). Отобранную пробу титруют раствором натрия гидроксида в присутствии фенолфталеина (2-3 капли). Результаты титрования записывают в таблицу 1.
|
из
5.00
|
Обсуждение в статье: Выполнение эксперимента. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

