|
Главная |
Расчет и анализ экспериментальных данных.
|
из
5.00
|
Данные опыта.
Таблица1
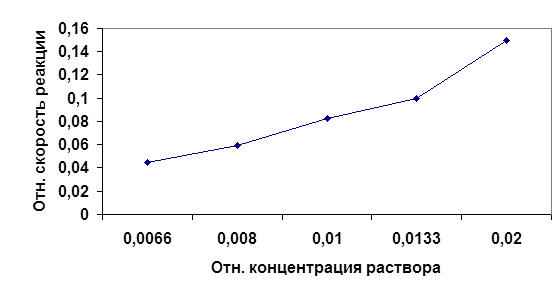
| № | Объем, мл | Относительная концентрация раствора Б (нормальность) | Время t,с | Относительная скорость реакции u=1/t, с-1 | |
| Раствор Б | Дистиллированная вода | ||||
| 1 | 10 | 0 | 0,02 | 6.8 | 0.15 |
| 2 | 10 | 5 | 0,0133 | 10 | 0.1 |
| 3 | 10 | 10 | 0,01 | 12 | 0.083 |
| 4 | 10 | 15 | 0,008 | 16.9 | 0.059 |
| 5 | 10 | 20 | 0,0066 | 22 | 0.045 |
2.1.3 Расчет и анализ экспериментальных данных.
Уравнение реакции:
2KIO3+5Na2SO3+H2SO4=I2+5Na2SO4+K2SO4+H2O
или
2IO3-+5SO32-+2H+=I2+5SO42-+H2O
|
|
Рис1.График зависимости скорости протекания реакции от концентрации реагирующих веществ.
Выводы.
Из графика видно, что скорость является функцией концентрации реагирующих веществ. Это следует из того, что реагируют те молекулы, которые сталкиваются. Поэтому, чем больше концентрация (и следовательно вероятность столкновения молекул ) реагентов, тем выше скорость протекания реакции.
Зависимость скорости реакции от температуры.
Описание хода работы.
В одну пробирку помещено 20 капель раствора щавелевой кислоты. В другой - 20 капель перманганата калия, 20 капель концентрированной серной кислоты (пробирка охлаждается под струей холодной воды). Обе пробирки и термометр вставляются в отверстие крышки, которой закрыт химический стакан, наполненный водой (пробирки и термометр не должны касаться дна стакана). После этого стакан ставится на электроплитку и вода нагревается до температуры 30*С. Затем содержимое пробирки с перманганатом калия выливается в пробирку со щавелевой кислотой, которая остается в стакане. Одновременно включается секундомер и выключается только при полном обесцвечивании растворов. Затем опыт повторяется при температурах 40°,50° и 60°С. Данные заносятся в таблицу.
Данные опыта.
Уравнение реакции:
5H2C2O+ 2KMnO4+3H2SO4=10CO2+2MnSO4+K2SO4+8H2O
или
5H2C2O4+2MnO4-+6H+=10CO2+2Mn2++8H2O.
Таблица 2
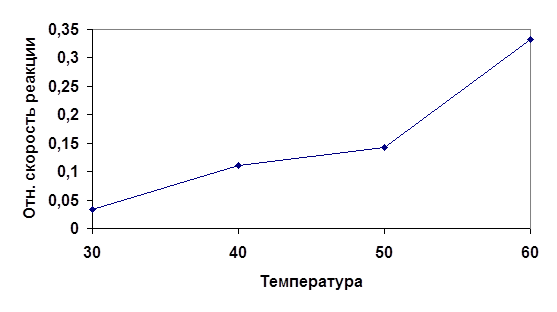
| № | Температура t, oC | Время от начала реакции до конца | Относительная скорость реакции u=1/t, с-1 |
| 1 | 30 | 30 | 0.033 |
| 2 | 40 | 9 | 0.111 |
| 3 | 50 | 7 | 0.142 |
| 4 | 60 | 3 | 0.333 |
|
|
Расчет и анализ экспериментальных данных.
Рис 2. График зависимости скорости протекания реакции от температуры.
Выводы.
Исходя из анализа полученных данных можно заключить, что скорость физико-химического процесса непосредственно зависит от температуры. Повышение температуры влечет за собой возрастания числа активных молекул, обладающих избыточной энергией. Избыточная энергия позволяет молекулам добиться того, чтобы столкновения были эффективными. Эта энергия также называется энергией активации.
2.3 Зависимость скорости гетерогенной реакции от величины поверхности реагирующих веществ.
Описание хода работы.
Даны 2 пробирке с 10% раствором соляной кислоты. В одну из них помещают мел, в другую – мрамор (в одинаковых количествах).
Данные опыта.
В пробирке с мелом реакция протекает более интенсивно. В пробирке с мрамором реакция протекает значительно медленнее.
Уравнение реакции:
CaCO3+2HCl = CaCl2+H20+CO2
2.3.3 Расчет и анализ экспериментальных данных.
Величина поверхности мела значительно больше, чем мрамора. Это связано с особенностями строения этих веществ. Мел имеет более рыхлую структуру чем мрамор.
2.3.4 Выводы.
Величина поверхности вещества влияет на скорость реакции. Чем больше поверхность вещества, тем больше скорость протекания гетерогенной реакции.
2.4 Влияние концентрации реагирующих веществ на состояние равновесия.
2.4.1 Описание хода работы.
В стакан налито 10 мл 2-х %-го раствора FeCl3 и добавлено 10 мл 1 %-го раствора KCNS. Полученный раствор разделен на 4 пробирки. В 1-ю добавляется 3-5 капель концентрированного раствора FeCl3, во вторую – 2-3 капли концентрированного раствора KCNS, в третью помещено немного твердого KCl. Четвертая пробирка является контрольной. Cравнивается интенсивность окраски полученных растворов. Данные записываются в таблицу.
Данные опыта.
Таблица 3
| № | Добавленное вещество | Изменение интенсивности окраски (усиление, ослабление) | Направление смещения равновесия |
| 1 | FeCl3 | Усиление | ® |
| 2 | KCNS | Усиление | ® |
| 3 | KCl | Ослабление | |
| 4 | –– | –– | « |
Уравнение реакции:

 FeCl3+3KCNS Fe(CNS)3+3KCL
FeCl3+3KCNS Fe(CNS)3+3KCL
Расчет и анализ экспериментальных данных.
В первой пробирке концентрация FeCl3 увеличилась, и интенсивность окраски усилилась, это связано с тем, что равновесие сместилось в сторону продукта реакции, усиливающего интенсивность окраски. Во второй пробирке увеличилась концентрация KCNS и интенсивность окраски усилилась т.к. равновесие сместилось в сторону продукта реакции, усиливающего интенсивность окраски. В третей пробирке увеличилась концентрация KCl и интенсивность окраски ослабилась, т.к. равновесие сместилось в сторону реагентов и скорость протекания реакции уменьшилась.
Выводы.
При увеличении концентрации исходных веществ равновесие смещается в сторону продуктов реакции. При увеличении продуктов реакции равновесие смещается в сторону исходных веществ. Это один из случаев действия принципа Ле-Шателье (изменение концентрации).
|
из
5.00
|
Обсуждение в статье: Расчет и анализ экспериментальных данных. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы