 |
Главная |
Концентрация растворов. Массовые доли.
|
из
5.00
|
Свойства растворов зависят не только от того, что и в чем растворено, но и от количественного содержания растворенного вещества. Это подтверждается многочисленными наблюдениями из повседневной жизни. Раствор обычной пищевой соли может иметь и сильно-, и средне-, и слабо соленый вкус.
Силу воздействия перманганата калия можно предвидеть по интенсивности окраски раствора. Одна таблетка лекарства действует слабее, чем две таблетки, так как в обоих случаях лекарство распределяется в одном и том же объеме организма.
В чем источник различия между растворами одного и того же вещества? Может быть, это разные массы вещества? Или разные объемы растворов? Посмотрим, как это выглядит на практике.
Опыт 1. Чайную ложку соли растворяют в стакане воды, а столовую ложку – в ведре воды. Какой раствор окажется солонее? Все быстро дают один и тот же правильный ответ: раствор в стакане. Соли растворено в ведре воды в 4 раза больше, чем в стакане, но при этом объем ведра в 40 раз больше, чем объем стакана. Именно поэтому раствор в стакане солонее.
Мы подошли к строгому определению характеристики раствора, которую в повседневной жизни часто называют крепость (крепкая серная кислота, крепкий напиток), а в науке принят термин «концентрация».
Концентрация – это относительное содержание растворенного вещества.
Применяются различные виды количественного выражения концентрации.
Массовая доля вещества в растворе – это отношение массы данного вещества к массе всего раствора:
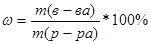

Пример 1. Приготовили раствор из 20г хлорида натрия и 80г воды. Найдите массовые доли вещества в растворе.
Решение. Пусть NaCl – вещество 1, а вода – 2:
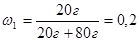
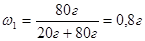
Соли и другие вещества можно растворять в воде как в безводном состоянии, так и в виде кристаллогидратов. Однако массовую долю целесообразно всегда выражать на основе содержания безводного вещества. Когда раствор приготовлен, уже невозможно установить, в каком состоянии было взято вещество для растворения. Чтобы не возникло путаницы, состав раствора должен выражаться единообразно.
Пример 2. В воде массой 80г растворили 20г декагидрата сульфата натрия
Na2SO4 10H2O. Рассчитайте массовую долю соли в растворе.
Решение. При растворении кристаллогидрата в раствор дополнительно вносится вода. Масса безводного вещества оказывается меньше, чем в примере 1, а масса воды больше. Рассчитаем массу безводного вещества, представив мысленно, что кристаллогидрат теряет воду:
Na2SO4 10H2O = Na2SO4 + 10H2O
М, г/моль 322 142
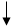 m, г 20 8,82
m, г 20 8,82
 n, моль 0,0621 0,0621
n, моль 0,0621 0,0621
Массу раствора вычислим по балансу, то есть сложим данные массы, так как они полностью пошли на образование раствора.
Получаем:
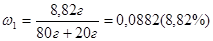
Рассмотрим решение задачи на повышение концентрации имеющегося раствора.
Пример 3. Какую массу сахара следует добавить к 180г раствора с массовой долей 15%, чтобы повысить массовую долю до 25%.
Решение. При добавлении сахара к раствору увеличивается как масса сахара, так и масса раствора. Сначала найдем имеющуюся массу сахара:
m0 = m p-p 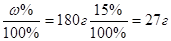
Далее вычисляем недостающую массу сахара, которую следует добавить:
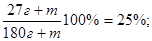 m=24
m=24
Пример 4. Найдите массу карбоната натрия в растворе объемом 200мл с массовой долей 14%. Плотность раствора 1,146г/мл.
Решение. По формуле: 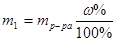
Массу раствора рассчитывают по данным условия:
m p-p = Vp
Подставляем численные значения:
m p-p = 200мл 1,146г/мл =229,2г
m1 = 229,2г 14%/100% = 32,1г.
При внесении вещества в растворитель может происходить химическая реакция, в результате чего получается раствор нового вещества.
Пример 5. Какую массу натрия следует внести в 1л воды, чтобы получить 20% раствор гидроксида натрия?
Решение. Натрия реагирует с водой, образуя гидроксид натрия и водород:
Na,m=? H2
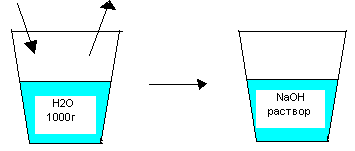
На основании данной схемы можно написать уравнение:
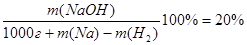
В этом уравнении 3 неизвестные массы, но они связаны между собой уравнением химической реакции:
2Na + 2H2O = 2NaOH + H2
M, г/моль 23 40 2
n0, моль 2х 0 0
nk, моль 0 2х х
m, г 2х 23 2х 40 х 2
Подставляем массы, выраженные через неизвестное х в уравнение:
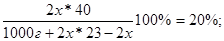 x=2,81моль
x=2,81моль
Находим массу натрия: m(Na) = 2 2,81моль 23г/моль = 129г.
Попутно можно отметить, что если бы действительно пришлось осуществлять работу, то натрий можно было бы добавлять лишь малыми порциями во избежание взрыва и пожара.
|
из
5.00
|
Обсуждение в статье: Концентрация растворов. Массовые доли. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

