|
Главная |
Способы повышения скорости процесса
|
из
5.00
|
Ионообменный метод обессоливания и умягчения воды
Метод ионного обмена основан на свойстве некоторых твёрдых тел (ионитов) поглощать из раствора ионы в обмен на эквивалентное количество других ионов того же знака. Иониты подразделяются на катиониты и аниониты. Катиониты содержат подвижные катионы натрия или водорода, а аниониты подвижные анионы гидроксила. В качестве катионитов применяют сульфоугли, алюмосиликаты (пермутит, цеолит и др.), в качестве анионитов искусственные смолы, например карбомидные.
Соответственно, процессы ионного обмена подразделяются на Н (Na) – катионирование, например:
Na2[Кат] + Ca(НСО3) ↔ Са[Кат] + 2Na2CO3
и анионирование, например:
Ан[OH] + HCl ↔ Ан[Cl] + H2O,
где: [Кат] и [Ан] – не участвующая в обмене матрица ионита.
Поскольку процесс ионного обмена обратим, установление равновесия в системе означает прекращение процесса обессоливания. Поглощающая способность ионита характеризуется его объёмной ёмкостью, равной количеству ионов кальция и магния, которое может поглотить единица объёма или массы ионита, выраженное в граммэквивалентах: г-экв/м3 и г-экв/кг. От величины обменной ёмкости при данном объёме ионита зависит время рабочего цикла ионитовых фильтров. При насыщении ионита он может быть регенерирован промывкой растворами для Н катионов кислоты, Na катионов хлорида натрия и для анионитов раствором щёлочи. В приведённых выше примерах работы анионитов при этом протекают реакции:
Са[Кат] + 2NaCl ↔ Na2[Кат] + CaCl2 и
[Ан]Cl + KOH ↔ [Ан]OH + KCl.
Полное обессоливание воды обеспечивается её дистилляцией (термическое обессоливание) обычно после того, как вода предварительно очищена с помощью ионитовых фильтров.
Вода постепенно проходит через катионовый и анионовый фильтры и поступает распыляясь в дегазатор, где из неё удаляют растворённый диоксид углерода, кислород и другие газы. Для регенерации катионита в фильтр периодически подаётся кислота или раствор хлорида натрия, для регенерации анионита – раствор щёлочи.
Умягчением называется обработка воды для понижения её жёсткости, т.е. уменьшения концентрации ионов Са+2 и Mg+2 различными физическими, химическими и физико-химическими методами.
При физическом методе воду нагревают до кипения, в результате чего растворимые гидрокарбонаты кальция и магния превращаются в и карбонаты, выпадающие в осадок:
Са(НСО3)2 = СаСО3 + Н2О + СО2.
Этим методом удаляется только временная жёсткость.
К химическим методам умягчения относятся фосфатный и известковосодовый, заключающиеся в обработке воды тринатрийфосфатом или смесью гидроксида кальция и карбоната натрия. В первом случае протекает реакция образования нерастворимого трикальцийфосфата, выпадающего в осадок:
3СаSO4 + 2Na3PO4 = 3Na2SO4 + Ca3(PO4)2.
Во втором случае протекают две реакции. Бикарбонаты магния и кальция реагируют с гидроксидом кальция, чем устраняется временная жёсткость:
Ca(HCO3) + Ca(OH)2 = 2CaCO3 + 2H2O,
а сульфаты, нитраты и хлориды – с карбонатом натрия, чем устраняется постоянная жёсткость:
CaSO4 + Na2CO3 = CaCO3 + Na2SO4.
Физико-химический метод ионообменного умягчения воды был описан выше.
Способы повышения скорости процесса
Скорость реакции определяется изменением молярной концентрации одного из реагирующих веществ:
V = ± ((С2 – С1) / (t2 – t1)) = ± (∆C/∆t)
где С1 и С2 - молярные концентрации веществ в моменты времени t1 и t2 соответственно (знак (+) – если скорость определяется по продукту реакции, знак (–) – по исходному веществу).
Реакции происходят при столкновении молекул реагирующих веществ. Ее скорость определяется количеством столкновений и вероятностью того, что они приведут к превращению. Число столкновений определяется концентрациями реагирующих веществ, а вероятность реакции - энергией сталкивающихся молекул.
Факторы, влияющие на скорость химических реакций.
1. Природа реагирующих веществ. Большую роль играет характер химических связей и строение молекул реагентов. Реакции протекают в направлении разрушения менее прочных связей и образования веществ с более прочными связями. Так, для разрыва связей в молекулах H2 и N2 требуются высокие энергии; такие молекулы мало реакционноспособны. Для разрыва связей в сильнополярных молекулах (HCl, H2O) требуется меньше энергии, и скорость реакции значительно выше. Реакции между ионами в растворах электролитов протекают практически мгновенно.
Примеры
Фтор с водородом реагирует со взрывом при комнатной температуре, бром с водородом взаимодействует медленно и при нагревании.
Оксид кальция вступает в реакцию с водой энергично, с выделением тепла; оксид меди - не реагирует.
2. Концентрация. С увеличением концентрации (числа частиц в единице объема) чаще происходят столкновения молекул реагирующих веществ - скорость реакции возрастает.
Закон действующих масс (К. Гульдберг, П.Вааге, 1867г.)
Скорость химической реакции прямо пропорциональна произведению концентраций реагирующих веществ.
aA + bB + . . . →. . .
V = k • [A]a • [B]b • . . .
Константа скорости реакции k зависит от природы реагирующих веществ, температуры и катализатора, но не зависит от значения концентраций реагентов.
Физический смысл константы скорости заключается в том, что она равна скорости реакции при единичных концентрациях реагирующих веществ.
Для гетерогенных реакций концентрация твердой фазы в выражение скорости реакции не входит.
3. Температура. При повышении температуры на каждые 10C скорость реакции возрастает в 2-4 раза (Правило Вант-Гоффа). При увеличении температуры от t1 до t2 изменение скорости реакции можно рассчитать по формуле:
| (t2 - t1) / 10 | ||
| Vt2 / Vt1 | = |
(где Vt2 и Vt1 - скорости реакции при температурах t2 и t1 соответственно; - температурный коэффициент данной реакции).
Правило Вант-Гоффа применимо только в узком интервале температур. Более точным является уравнение Аррениуса:
k = A • e –Ea/RT
где
A - постоянная, зависящая от природы реагирующих веществ;
R - универсальная газовая постоянная [8,314 Дж/(моль • К) = 0,082 л • атм/(моль • К)];
Ea - энергия активации, т.е. энергия, которой должны обладать сталкивающиеся молекулы, чтобы столкновение привело к химическому превращению.
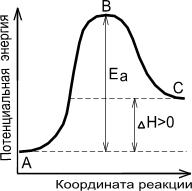
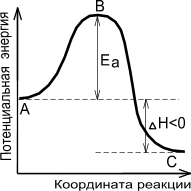
Энергетическая диаграмма химической реакции.
|
| |||
| Экзотермическая реакция | Эндотермическая реакция | |||
А - реагенты, В - активированный комплекс (переходное состояние), С - продукты.
Чем больше энергия активации Ea, тем сильнее возрастает скорость реакции при увеличении температуры.
4. Поверхность соприкосновения реагирующих веществ. Для гетерогенных систем (когда вещества находятся в разных агрегатных состояниях), чем больше поверхность соприкосновения, тем быстрее протекает реакция. Поверхность твердых веществ может быть увеличена путем их измельчения, а для растворимых веществ - путем их растворения.
5. Катализ. Вещества, которые участвуют в реакциях и увеличивают ее скорость, оставаясь к концу реакции неизменными, называются катализаторами. Механизм действия катализаторов связан с уменьшением энергии активации реакции за счет образования промежуточных соединений. При гомогенном катализе реагенты и катализатор составляют одну фазу (находятся в одном агрегатном состоянии), при гетерогенном катализе - разные фазы (находятся в различных агрегатных состояниях). Резко замедлить протекание нежелательных химических процессов в ряде случаев можно добавляя в реакционную среду ингибиторы (явление "отрицательного катализа").
|
из
5.00
|
Обсуждение в статье: Способы повышения скорости процесса |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы