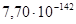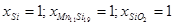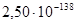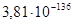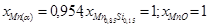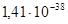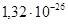|
Главная |
Расчет и построение диаграммы состояния Mn -Si-O при 250С. Анализ химической устойчивости
|
из
5.00
|
Как следует из экспериментальных данных по системе марганец-кремний (рис.1.1), кремний-кислород (рис.1.4) и марганец-кислород (рис.1.5) в системе Mn-Si-O можно предположить существование областей, в которых присутствуют следующие фазы (поскольку химическое сродство кремния к кислороду выше, чем марганца, то вероятнее, что почти при любом составе сплава Mn-Si в первую очередь будет реализовываться равновесие сплав – SiO2):
1. Si(γ) – Mn11Si19 – SiO2; (I)
2. Mn11Si19 – MnSi –SiO2; (II)
3. MnSi – Mn5Si3 – SiO2; (III)
4. Mn5Si3 – Mn5Si2 – SiO2; (IV)
5. Mn5Si2– Mn3Si – SiO2; (V)
6. Mn3Si – Mn9Si2 – SiO2; (VI)
7. Mn9Si2 – R(Mn6Si) – SiO2; (VII)
8. R(Mn6Si) – α-фаза – SiO2; (VIII)
9. α-фаза – SiO2; (IX)
10. α-фаза ––MnSiO3–SiO2; (X)
11. α-фаза ––Mn2SiO4–MnSiO3; (XI)
12. α-фаза ––MnO– Mn2SiO4; (XII)
13. MnO–Mn3O4– Mn2SiO4; (XIII)
14. Mn3O4– Mn2SiO4– MnSiO3; (XIV)
15. Mn3O4–Mn2O3– MnSiO3; (XV)
16. Mn2O3– MnSiO3–SiO2; (XVI)
17. Mn2O3–MnO2–SiO2; (XVII)
18. MnO2–Mn2O7–SiO2; (XVIII)
19. Mn2O7–SiO2–{O2}; (XIX)
Для того, чтобы однозначно определить инвариантное состояние системы, необходимо задать равновесные составы сосуществующих фаз и давление кислорода в газовой фазе, равновесной с конденсированными фазами.
Примеры расчета:
а) Фазовое равновесие V: Mn5Si2– Mn3Si – SiO2
Уравнение реакции, соответствующее данному равновесию:
 (1)
(1)
Константа равновесия реакции (1):
 ; (2.1)
; (2.1)
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
 ; (2.2)
; (2.2)
Уравнение изотермы химической реакции:
 ; (2.3)
; (2.3)
Энергия Гиббса реакции (1) рассчитывается по формуле:
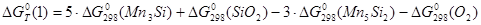 ; (2.4)
; (2.4)
С учетом уравнения (2.2):
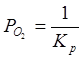
б) Фазовое равновесие X:
α-фаза ––MnSiO3–SiO2 было описано независимыми реакциями образования SiO2 и MnSiO3 из компонентов α-фазы (Mn, Si) и компонентов газовой фазы O2:
(1) 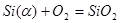 ;
;
(2)  ;
;

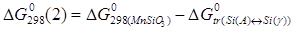
Константы равновесия реакций 1 и 2:
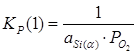 ; (2.3)
; (2.3)
 ; (2.4)
; (2.4)
Для определения состава α-фазы исключим  из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в куб и поделим полученное на уравнение (2.4), получим:
из конечного термодинамического уравнения. Для этого возведем уравнение (2.3) в куб и поделим полученное на уравнение (2.4), получим:
 ; (2.5)
; (2.5)
Это уравнение можно переписать в виде:
 ; (2.6)
; (2.6)
Из уравнения изотермы химической реакции:
 ; (2.7)
; (2.7)
уравнение (2.3.4) можно переписать:
 ; (2.8)
; (2.8)
Данное трансцендентное уравнение можно решить только численным методом. Обозначив  ,
,  , получим:
, получим:
 ; (2.9)
; (2.9)
 ; (2.10)
; (2.10)
Подставив уравнения (2.9) и (2.10) в (2.8) решаем численным методом, находим значение х. Исходя из уравнений (2.3) или (2.4) определяем величину  .
.
Полученные результаты сведены в таблице 2.6.
Табл.2.6 Характеристики фазовых равновесий системы Mn-Si-O при 25 0С
| Состояние | Уравнение реакции | 
| 
|
| Si – Mn11Si19 – SiO2 | Si(A) + O2 = SiO2 | 805067 | 7,7e-142 |
| Mn11Si19 – MnSi –SiO2 | Mn11Si19 + 8O2 = 11MnSi + 8SiO2 | 789464 | 4,18E-139 |
| MnSi – Mn5Si3 – SiO2 | 5MnSi + 2O2 = Mn5Si3 + 2SiO2 | 757015 | 2,04E-133 |
| Mn5Si3 – Mn5Si2 – SiO2 | Mn5Si3 + O2 = Mn5Si2 + SiO2 | 742497 | 7,14E-131 |
| Mn5Si2– Mn3Si – SiO2 | 3Mn5Si2 + O2 = 5Mn3Si + SiO2 | 739167 | 2,74E-130 |
| Mn3Si – Mn9Si2 – SiO2 | 3Mn3Si + O2 = Mn9Si2 + SiO2 | 736728 | 7,33E-130 |
| Mn9Si2 – Mn6Si – SiO2 | 2Mn9Si2 + O2 = 3Mn6Si + SiO2 | 702737 | 1,99E-129 |
| Mn6Si – α – SiO2 xSi(α)=0,0361; aMn(α)=0,91 | Mn6Si + O2 = 6Mn(α) + SiO2 | 693587 | 3,77E-122 |
| α – SiO2 | Si(α)+O2=SiO2 Mn(α)+Si(α)+1,5O2=MnSiO3 | ||
| α ––MnSiO3–SiO2 | 2,3Е-128 | ||
| α ––Mn2SiO4–MnSiO3 | - | - | - |
| α ––MnO– Mn2SiO4 | - | - | - |
| MnO–Mn3O4– Mn2SiO4 | 6MnO + O2 = 2Mn3O4 | 387290 | 1,3E-68 |
| Mn3O4– Mn2SiO4– MnSiO3 | 6Mn2SiO4 + O2 = 6MnSiO3 + 2Mn3O4 | 375710 | 1,4E-66 |
| Mn3O4–Mn2O3– MnSiO3 | 4Mn3O4 + O2 = 6Mn2O3 | 147860 | 1,21E-26 |
| Mn2O3–MnO2–MnSiO3 | 2Mn2O3 + O2 = 4MnO2 | 102920 | 9,1E-19 |
| MnO2 – MnSiO3 – SiO2 | 2MnSiO3 + O2 = 2MnO2 + 2SiO2 | 200474 | 7,25E-36 |
| MnO2–Mn2O7–SiO2 | 4MnO2 + 3O2 = 2Mn2O7 | 1335600 | 1,09E+78 |
| Mn2O7–SiO2–{O2} |
кремний марганец термодинамический химический равновесие
Рассчитать равновесия 10-12 не представляется возможным, что может свидетельствовать о том, что какой-либо из силицидов окисляется до силиката раньше, чем α-фаза. С этим же может быть связана и неупорядоченная последовательность вычисленных значений Р(О2).
Для того, чтобы показать термодинамическую возможность или невозможность осуществления реакций между оксидами марганца и кремния в равновесии с альфа-фазой, выполнены следующие расчёты. Для каждой из возможных реакций вычислен интервал значений Q12, удовлетворяющий условию возможности протекания этой реакции при в области составов системы Mn – Si, при которой альфа-фаза термодинамически устойчива.
1) 
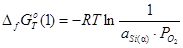 ;
;
 ;
;
 ;
;
 .
.
2) 
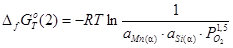 ;
;
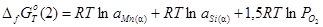 ;
;
 ;
;
 .
.
3) 
 ;
;
 ;
;
 ;
;
 .
.
4) 
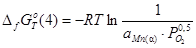 ;
;
 ;
;
 ;
;
 .
.
При оценке параметров Q12 необходимо учесть следующие условия: а) мольная доля кремния в альфа-фазе должна находиться в пределах существования альфа-фазы –  ; б) давление кислорода в газовой фазе над конденсированной фазой не должно быть больше значения, при котором возможно окисление чистого марганца –
; б) давление кислорода в газовой фазе над конденсированной фазой не должно быть больше значения, при котором возможно окисление чистого марганца – 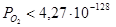 атм. Подставляя в выражения для энергий смешения значения энергий Гиббса реакций (1) – (4), получаем следующие неравенства:
атм. Подставляя в выражения для энергий смешения значения энергий Гиббса реакций (1) – (4), получаем следующие неравенства:
Для реакции (1):  ,
,
Для реакции (2):  ,
,
Для реакции (3): 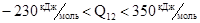 ,
,
Для реакции (4): 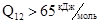 .
.
Сравнивая между собой полученные значения Q12, можно прийти к выводу о том, что протекание реакций между оксидами марганца и кремния в равновесии с альфа-фазой невозможно.
Таким образом, предположение о том, что окисление SiO2 до MnSiO3, MnSiO3 до Mn2SiO4, Mn2SiO4 до MnO реализуются в равновесии с альфа-фазой, не подтвердилось. Поэтому необходимо проверить предположение о том, что вышеуказанные реакции реализуются в равновесии с одним из силицидов марганца. Для этого были рассмотрены все возможные трёхфазные равновесия в системе Mn-Si-O, которые представлены в таблице.
Табл. 2.7 Все возможные трёхфазные равновесия в системе Mn-Si-O
| Состояние | Уравнение реакции |
| Si – Mn11Si19 – SiO2 | Si(A) + O2 = SiO2 |
| Mn11Si19 – MnSi –SiO2 | Mn11Si19 + 8O2 = 11MnSi + 8SiO2 |
| MnSi – Mn5Si3 – SiO2 | 5MnSi + 2O2 = Mn5Si3 + 2SiO2 |
| Mn5Si3 – Mn5Si2 – SiO2 | Mn5Si3 + O2 = Mn5Si2 + SiO2 |
| Mn5Si2– Mn3Si – SiO2 | 3Mn5Si2 + O2 = 5Mn3Si + SiO2 |
| Mn3Si – Mn9Si2 – SiO2 | 3Mn3Si + O2 = Mn9Si2 + SiO2 |
| Mn9Si2 – Mn0,85Si0,15 – SiO2 | 17Mn9Si2 + 7O2 = 180Mn0,85Si0,15 + 7SiO2 |
| Mn0,85Si0,15 – α – SiO2 xSi(α)=0,042; aMn(α)=0,855 | 20Mn0,85Si0,15 + 3O2 = 17Mn(α) + 3SiO2 |
| ================= | ================= |
| Mn11Si19 – SiO2 – MnSiO3 | 2Mn11Si19 + 49O2 = 22MnSiO3 + 16SiO2 |
| MnSi – SiO2 – MnSiO3 | 2MnSi + 0SiO2 + 3O2 = 2MnSiO3 |
| Mn5Si3 – SiO2 – MnSiO3 | 2Mn5Si3 + 4SiO2 + 11O2 = 10MnSiO3 |
| Mn5Si2 – SiO2 – MnSiO3 | 2Mn5Si2 + 6SiO2 + 9O2 = 10MnSiO3 |
| Mn3Si – SiO2 – MnSiO3 | 2Mn3Si + 4SiO2 + 5O2 = 6MnSiO3 |
| Mn9Si2 – SiO2 – MnSiO3 | 2Mn9Si2 + 14SiO2 + 13O2 = 18MnSiO3 |
| Mn0,85Si0,15 – SiO2 – MnSiO3 | 40Mn0,85Si0,15 + 28SiO2 + 23O2 = 34MnSiO3 |
| ================== | ================= |
| Si – Mn11Si19 – MnSiO3 | 2Mn11Si19 + 33O2 = 22MnSiO3 + 16Si |
| Mn11Si19 – MnSi – MnSiO3 | 0Mn11Si19 + 2MnSi + 3O2 = 2MnSiO3 |
| MnSi – Mn5Si3 – MnSiO3 | 2MnSi + 3O2 = 0Mn5Si3 + 2MnSiO3 |
| Mn5Si3 – Mn5Si2 – MnSiO3 | 6Mn5Si3 + 15O2 = 4Mn5Si2 + 10MnSiO3 |
| Mn5Si2– Mn3Si – MnSiO3 | 4Mn5Si2 + 3O2 = 6Mn3Si + 2MnSiO3 |
| Mn3Si – Mn9Si2 – MnSiO3 | 14Mn3Si + 9O2 = 4Mn9Si2 + 6MnSiO3 |
| Mn9Si2 – Mn0,85Si0,15 – MnSiO3 | 4Mn9Si2 + 3O2 = 40Mn0,85Si0,15 + 2MnSiO3 |
| Mn0,85Si0,15 – α – MnSiO3 xSi(α)=0,042; aMn(α)=0,855 | 40Mn0,85Si0,15 + 9O2 = 28Mn(α) + 6MnSiO3 |
| ================== | ================= |
| Mn11Si19 – MnSiO3 – Mn2SiO4 | 2Mn11Si19 + 16Mn2SiO4 + 49O2 = 54MnSiO3 |
| MnSi – MnSiO3 – Mn2SiO4 | 2MnSi + 3O2 = 0Mn2SiO4 + 2MnSiO3 |
| Mn5Si3 – MnSiO3 – Mn2SiO4 | 2Mn5Si3 + 11O2 = 2MnSiO3 + 4Mn2SiO4 |
| Mn5Si2 – MnSiO3 – Mn2SiO4 | 2Mn5Si2 + 2MnSiO3 + 9O2 = 6Mn2SiO4 |
| Mn3Si – MnSiO3 – Mn2SiO4 | 2Mn3Si + 2MnSiO3 + 5O2 = 4Mn2SiO4 |
| Mn9Si2 – MnSiO3 – Mn2SiO4 | 2Mn9Si2 + 10MnSiO3 + 13O2 = 14Mn2SiO4 |
| Mn0,85Si0,15 – MnSiO3 – Mn2SiO4 | 40Mn0,85Si0,15 + 22MnSiO3 + 23O2 = 28Mn2SiO4 |
| ================== | ================= |
| Si – Mn11Si19 – Mn2SiO4 | 2Mn11Si19 + 22O2 = 27Si + 11Mn2SiO4 |
| Mn11Si19 – MnSi – Mn2SiO4 | 27MnSi + 16O2 = Mn11Si19 + 8Mn2SiO4 |
| MnSi – Mn5Si3 – Mn2SiO4 | Mn5Si3 + 4O2 = MnSi + 2Mn2SiO4 |
| Mn5Si3 – Mn5Si2 – Mn2SiO4 | Mn5Si3 + Mn5Si2 + 10O2 = 5Mn2SiO4 |
| Mn5Si2– Mn3Si – Mn2SiO4 | Mn5Si2 + 2O2 = Mn3Si + Mn2SiO4 |
| Mn3Si – Mn9Si2 – Mn2SiO4 | 5Mn3Si + 6O2 = Mn9Si2 + 3Mn2SiO4 |
| Mn9Si2 – Mn0,85Si0,15 – Mn2SiO4 | 11Mn9Si2 + 14O2 = 100Mn0,85Si0,15 + 7Mn2SiO4 |
| Mn0,85Si0,15 – α – Mn2SiO4 xSi(α)=0,042; aMn(α)=0,855 | 20Mn0,85Si0,15 + 6O2 = 11Mn(α) + 3Mn2SiO4 |
| ================== | ================= |
| Mn11Si19 – Mn2SiO4 – MnO | 2Mn11Si19 + 54MnO + 49O2 = 38Mn2SiO4 |
| MnSi – Mn2SiO4 – MnO | 2MnSi + 2MnO + 3O2 = 2Mn2SiO4 |
| Mn5Si3 – Mn2SiO4 – MnO | 2Mn5Si3 + 2MnO + 11O2 = 6Mn2SiO4 |
| Mn5Si2 – Mn2SiO4 – MnO | 2Mn5Si2 + 9O2 = 4Mn2SiO4 + 2MnO |
| Mn3Si – Mn2SiO4 – MnO | 2Mn3Si + 5O2 = 2Mn2SiO4 + 2MnO |
| Mn9Si2 – Mn2SiO4 – MnO | 2Mn9Si2 + 13O2 = 4Mn2SiO4 + 10MnO |
| Mn0,85Si0,15 – Mn2SiO4 – MnO | 40Mn0,85Si0,15 + 23O2 = 6Mn2SiO4 + 22MnO |
| ================== | ================= |
| Si – Mn11Si19 – MnO | 2Mn11Si19 + 11O2 = 38Si(A) + 22MnO |
| Mn11Si19 – MnSi – MnO | 19MnSi + 4O2 = Mn11Si19 + 8MnO |
| MnSi – Mn5Si3 – MnO | Mn5Si3 + O2 = 3MnSi + 2MnO |
| Mn5Si3 – Mn5Si2 – MnO | 6Mn5Si2 + 5O2 = 4Mn5Si3 + 10MnO |
| Mn5Si2– Mn3Si – MnO | 4Mn3Si + O2 = 2Mn5Si2 + 2MnO |
| Mn3Si – Mn9Si2 – MnO | 2Mn9Si2 + 3O2 = 4Mn3Si + 6MnO |
| Mn9Si2 – Mn0,85Si0,15 – MnO | 80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 14MnO |
| Mn0,85Si0,15 – α – MnO xSi(α)=0,042; aMn(α)=0,855 | 2Mn(α) + O2 = 2MnO |
| ================== | ================= |
| MnO – Mn3O4 – Mn2SiO4 | 6MnO + O2 = 2Mn3O4 |
| Mn3O4 – Mn2SiO4 – MnSiO3 | 6Mn2SiO4 + O2 = 6MnSiO3 + 2Mn3O4 |
| Mn3O4 – Mn2O3 – MnSiO3 | 4Mn3O4 + O2 = 6Mn2O3 |
| Mn2O3 – MnO2 – MnSiO3 | 2Mn2O3 + O2 = 4MnO2 |
| MnO2 – MnSiO3 – SiO2 | 2MnSiO3 + O2 = 2MnO2 + 2SiO2 |
| MnO2 – Mn2O7 – SiO2 | 4MnO2 + 3O2 = 2Mn2O7 |
| Mn2O7 – SiO2 – {O2} |
Задача состоит в том, чтобы подобрать последовательность равновесий, которая бы удовлетворяла условию возрастания давления кислорода в системе. При этом возможно проводить варьирование значений энергий Гиббса образования силицидов в пределах возможных справочных значений.
После многократного согласования энергий Гиббса образования силицидов, взятых из различных источников, получен следующий вариант последовательности окисления.
1. Si – Mn11Si19 – SiO2; (I)
2. Mn11Si19 – MnSi – SiO2; (II)
3. MnSi– Mn5Si3– SiO2; (III)
4. Mn5Si3 – MnSiO3– SiO2; (IV)
5. Mn5Si3 – MnSiO3 – Mn2SiO4; (V)
6. Mn5Si3 – Mn5Si2 – Mn2SiO4; (VI)
7. Mn5Si2– Mn3Si – Mn2SiO4; (VII)
8. Mn3Si –Mn2SiO4 – MnO; (VIII)
9. Mn9Si2 – Mn3Si – MnO; (IX)
10. Mn0,85Si0,15 – Mn9Si2 – MnO; (X)
11. α – Mn0,85Si0,15– MnO; (XI)
12. MnO – Mn3O4 – Mn2SiO4; (XII)
13. Mn3O4 – Mn2SiO4 – MnSiO3; (XIII)
14. Mn3O4 – Mn2O3 – MnSiO3; (XIV)
15. Mn2O3 – MnO2 – MnSiO3; (XV)
16. MnO2 – MnSiO3 – SiO2; (XVI)
17. MnO2 – Mn2O7 – SiO2; (XVII)
18. Mn2O7–SiO2–{O2}; (XVIII)
Примеры расчета:
а) Фазовое равновесие III: MnSi– Mn5Si3 – SiO2
Уравнение реакции, соответствующее данному равновесию:
 (1)
(1)
Константа равновесия реакции (1):
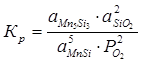 ; (2.1)
; (2.1)
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:

 ; (2.2)
; (2.2)
Уравнение изотермы химической реакции:
 ; (2.3)
; (2.3)
Энергия Гиббса реакции (1) рассчитывается по формуле:
 ; (2.4)
; (2.4)
С учетом уравнения (2.2):

б) Фазовое равновесие X:
Mn0,85Si0,15 – Mn9Si2 – MnO
Уравнение реакции, соответствующее данному равновесию:
80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 4MnO
Константа равновесия реакции (2):
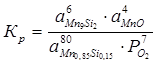 ;
;
Мольные доли компонентов равны единице, поэтому выражение для константы равновесия упрощается:
 ;
;
Дальнейшие расчёты аналогичны предыдущему.
в) Фазовое равновесие XI:
α – Mn0,85Si0,15– MnO
Уравнение реакции, соответствующее данному равновесию:
2Mn(α)+O2=2MnO
Константа равновесия реакции (3):
 ;
;
Мольная доля чистого вещества равна единице, поэтому выражение для константы равновесия упрощается:
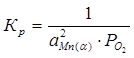 (4)
(4)
Равновесие MnO с альфа-фазой является моновариантным, поэтому давление кислорода в газовой фазе, равновесной с конденсированной фазой, будет зависеть от активности марганца в альфа-фазе. Однозначно определить его можно, например, для точки, соответствующей предельной растворимости кремния в марганце. В этой точке мольная доля кремния  ,
,  и
и 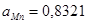 .
.

Рис.2.1. Фазовая диаграмма состояния системы Mn-Si-O при 25 0С.
Таблица 2.8 Характеристики фазовых равновесий системы Mn-Si-O при 25 0С
| № | Равновесие | Уравнение реакции |
| Равновесный состав фаз | ||||
| I | Si – Mn11Si19 – SiO2 | Si(A) + O2 = SiO2 |
|
| ||||
| II | Mn11Si19 – MnSi – SiO2 | Mn11Si19 + 8O2 = 11MnSi + 8SiO2 |
|
| ||||
| III | MnSi– Mn5Si3– SiO2 | 5MnSi + 2O2 = Mn5Si3 + 2SiO2 |
|
| ||||
| IV | Mn5Si3 – MnSiO3– SiO2 | 2Mn5Si3 + 4SiO2 + 11O2 = 10MnSiO3 |
|
| ||||
| V | Mn5Si3 – Mn5Si2–MnSiO3 | 6Mn5Si3 + 15O2 = 4Mn5Si2 + 10MnSiO3 |
|
| ||||
| VI | Mn5Si2–MnSiO3–Mn2SiO4 | 2Mn5Si2 + 2MnSiO3 + 9O2 = 6Mn2SiO4 |
|
| ||||
| VII | Mn5Si2– Mn3Si – Mn2SiO4 | Mn5Si2 + 2O2 = Mn3Si + Mn2SiO4 |
|
| ||||
| VIII | Mn3Si –Mn2SiO4 - MnO | 2Mn3Si + 5O2 = 2Mn2SiO4 + 2MnO |
|
| ||||
| IX | Mn9Si2 – Mn3Si – MnO | 2Mn9Si2 + 3O2 = 4Mn3Si + 6MnO |
|
| ||||
| X | Mn0,85Si0,15–Mn9Si2–MnO | 80Mn0,85Si0,15 + 7O2 = 6Mn9Si2 + 4MnO |
|
| ||||
| XI | α – Mn0,85Si0,15– MnO | 2Mn(α)+O2=2MnO |
|
| ||||
| XII | α– MnO | |||||||
| XIII | MnO – Mn3O4 – Mn2SiO4 | 6MnO + O2 = 2Mn3O4 |
|
| ||||
| XIV | Mn3O4–Mn2SiO4–MnSiO3 | 6Mn2SiO4 + O2 = 6MnSiO3 + 2Mn3O4 |
|
| ||||
| XV | Mn3O4 – Mn2O3 – MnSiO3 | 4Mn3O4 + O2 = 6Mn2O3 |
|
| ||||
| XVI | Mn2O3 – MnO2 – MnSiO3 | 2Mn2O3 + O2 = 4MnO2 |
| 
| ||||
| XVII | MnO2 – MnSiO3 – SiO2 | 2MnSiO3 + O2 = 2MnO2 + 2SiO2 |
| 
| ||||
| XVIII | MnO2 – Mn2O7 – SiO2 | 4MnO2 + 3O2 = 2Mn2O7 |
| 
| ||||
| XIX | Mn2O7–SiO2–{O2} |
|
| |||||
Список литературы
1. Гельд П. В., Сидоренко Ф. А. Силициды переходных металлов четвертого периода. М.: Металлургия, 1971. С. 120 – 143.
2. Диаграммы состояния двойных металлических систем. Под общей ред. Н. П. Лякишева. М.: Машиностроение, 1997-2000. Т. 3 кн.1. С. 361,383,698
3. «Твёрдые растворы. Химическая энциклопедия»
http://www.xumuk.ru/encyklopedia/2/4329.html
4. Тюрин А. Г. Термодинамика химической и электрохимической устойчивости сплавов: Учеб. Пособие в 2 ч. Часть 1.Общие принципы. Высокотемпературное окисление. Челябинск: Изд-во ЧелГУ, 2004. 86 с.
5. «Интерметаллиды. Химическая энциклопедия». 02.06.2009.
http://www.xumuk.ru/encyklopedia/1712.html
6. Мосунова Т.В. Термодинамика химической и электрохимической устойчивости сплавов системы Co-Si: дипломная работа // рук. Тюрин А.Г. Челябинск, 2001. 56 с.
7. Тюрин А.Г. Моделирование термодинамических свойств растворов: Учебное пособие; Челябинск: ЧелГУ, 1997. 74 с.
8. О. Кубашевски. Диаграммы состояния двойных систем на основе железа: справ. изд. / пер. с англ. М.: Металлургия, 1985. С. 175 – 179.
9. Могутнов Б. М., Томилин И. А., Шварцман Л. А. Термодинамика сплавов железа. М.: Металлургия, 1984. 208 с.
10. Рузинов Л. П., Гуляницкий Б. С. Равновесные превращения металлургических реакций. М.: Металлургия, 1975. 416 с.
11. База данных «Термические константы веществ».
12. Моисеев и др. Температурные зависимости приведённой энергии Гиббса.
13. Ерёменко и др. Физическая химия неорганических материалов.
|
из
5.00
|
Обсуждение в статье: Расчет и построение диаграммы состояния Mn -Si-O при 250С. Анализ химической устойчивости |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы


 , атм.
, атм.