 |
Главная |
РАСПОЗНАВАНИЕ УДОБРЕНИЙ ПО ХИМИЧЕСКИМ РЕАКЦИЯМ.
|
из
5.00
|
В целях распознавания минеральные удобрения подразделяют на две группы – растворимые в воде и нерастворимые.
Удобрения кристаллического сложения являются растворимыми, аморфные – нерастворимыми. К растворимым относят два вида удобрений – азотные и калийные, к нерастворимым – фосфорные (несколько условно) и известковые.
Распознавание твердых растворимых в воде удобрений
Азотные удобрения. По усвояемым соединениям азота данный вид удобрений подразделяют на следующие группы (формы).
1. Аммонийные (имеющие в своем составе группу NН4+)
сульфат аммония, ( N Н4)2 S О4 – 20,5 % N;
хлорид аммония, N Н4С I – 24 – 25% N;
аммофос, N Н4Н2РО4 – 11% N, 46-60% Р2О5;
диаммофос, ( N Н4)2 НРО4 – 19% N, 46-51% Р2О5.
Два последних удобрения являются сложными.
2. Нитратные (имеющие в своем составе группу NО3-) или селитры;
натриевая селитра, N а N О3 – 15-16% N;
калийная селитра, К N О3 – 13% N, 46% К2О;
кальциевая селитра, Са( NO 3 )2 -- 13 -15% N.
Калийная селитра является сложным удобрением.
3. Аммонийно- нитратные– в настоящее время эта группа представлена одним, но очень распространенным удобрением – аммонийной селитрой, N Н4 N О3 – 34,7% N.
4. Амидные (имеющие в своем составе амидную группу – NН2); мочевина (синонимы: карбамид, полный амид угольной кислоты) ,СО( N Н2)2 – 46% N.
Калийные удобрения. Классификация калийных удобрений производится по наличию или отсутствию в них хлора на две группы (формы): хлорсодержащие и бесхлорные. Подразделяют их также на низкопроцентные и концентрированные.
1. Хлорсодержащие калийные удобрения:
хлорид калия, КС l - содержит около 60% К2О;
40% калийная соль- смесь хлорида калия КСI с минералом сильвинитом
( m КС I + n N аС I ),содержит 38-42% К2О.
2. Бесхлорные калийные удобрения:
сульфат калия, К2 S О4 – 46-52% К2О;
углекислый калий (поташ), К2СО3 – 50% К2О;
калийная селитра, К N О3 – 13% N, 46% К2О;
калимагнезия (К2 S О4 × М gSO 4 ), 29% К2О и 9% MgO.
Качественные реакции при распознавании растворимых в воде удобрений.
Все растворимые удобрения, за исключением мочевины, являются электролитами, в растворе диссоциируют на катионы и анионы. Качественное распознавание удобрений сводится, таким образом, к открытию катионов и анионов, слагающих удобрения.
Открытие катионов
N Н4+ - открывается действием щелочи на порошок или гранулы удобрения. Заменителем едкой щелочи в обиходе и на производстве могут быть древесная зола, известь гашеная, сода питьевая и т.п. Запах аммиака свидетельствует о присутствии в удобрении NН4+.
N Н4 N О3 + N аОН = N а N О3 + N Н4ОН
N Н4ОН ® N Н3 + Н2О
При проведении реакции в растворе удобрения выделение аммиака менее четкое, требуется дополнительное подогревание. Выделение аммиака из удобрения при сухом прокаливании его не является доказательством того, что данное удобрение аммонийное, т.к. и мочевина в таких условиях выделяет аммиак.
К+ - открывают в растворе реактивом кобальтнитритом натрия. Выпадает оранжево-желтый осадок - кобальтнитрит калия-натрия (комплексная соль).
2КС I + N а3 [ Со( N О2)6 ] = ¯ К2 N а [ Со( N О2)6 ] + 2 N аС I
Точно такой же по внешнему виду осадок этот реактив образует и с ионом аммония. Поэтому прежде, чем проводить пробу на калий, надо убедиться в отсутствии в удобрении иона аммония. То есть, открытие катионов следует начинать с аммония и при его отсутствии переходить к другим катионам.
Са2+ - открывают в растворе реактивом оксалатом аммония.
Выпадает белый осадок щавелевокислого кальция.
Са ( N О3)2 + ( N Н4)2 С2О4 = ¯ СаС2О4 + 2 N Н4 N О3
Осадок легко растворим в кислотах; растворимость осадка в кислоте является подтверждением, что выпал осадок именно щавелевокислого кальция. Проба на растворимость осадка обязательна.
N а+ - при введении нескольких кристаллов или раствора удобрения в пламя оно окрашивается в ярко – желтый цвет.
Открытие анионов
С I - - открывают в растворе реактивом нитратом серебра.
Выпадает белый осадок хлорида серебра, который при взбалтывании пробирки собирается в комья. На ярком солнечном свету темнеет в силу выделения металлического серебра.
КС I + А gN О3 = ¯ А g С I + К N О3
Осадок хлорида серебра нерастворим в азотной кислоте (проверить).
Н2РО4- – открывают в растворе реактивом нитратом серебра. Выпадает осадок дигидрофосфат серебра. Осадок желтого цвета, легко растворим в азотной кислоте.
N Н4Н2РО4 + А gN О3 = ¯ А g Н2РО4 + N Н4 N О3
S О42- – открывается в растворе реактивом хлоридом бария. Выпадает белый мелко – кристаллический осадок сульфата бария.
( N Н4)2 S О4 + ВаС I 2 = ¯ Ва S О4 + 2 N Н4С I
Осадок сульфата бария нерастворим в азотной кислоте (проверить).
N О3- – в чистую пробирку налить несколько капель реактива дифениламина и бросить в него кристаллики удобрения. Темно – синяя окраска укажет на присутствие нитратного иона.
В производственной обстановке селитры легко обнаруживаются «пробой на тлеющий уголек» – при помещении кристалликов удобрения на тлеющий материал (бумага, лучина, пучок соломы, огонек сигареты и т.п.) происходит энергичное искрение. Причина в том, что все селитры, как и сама азотная кислота, являются сильными окислителями.
СО32- – с реактивами нитратом серебра, хлоридом бария дает осадки, типичные для этих реактивов. Но эти осадки легко растворяются в кислотах, при этом наблюдается вскипание за счет выделения СО2.
К2СО3 + ВаС I 2 =  ВаСО3 + 2КС I
ВаСО3 + 2КС I
ВаСО3 + 2Н N О3 = Ва( N О3)2 + Н2О + СО2 
Для окончательной проверки следует поместить в пробирку немного удобрения и осторожно прилить несколько капель кислоты. Бурное вскипание подтвердит присутствие в удобрении аниона СО32-.
 Открытие мочевины. Мочевина реактивами непосредственно не обнаруживается. Быстрым, но недостаточно точным способом обнаружения мочевины является «проба на раскаленную поверхность» - брошенная в нагретую фарфоровую чашечку мочевина «вскипает», дымит и дает резкий запах аммиака. Однако аналогичным образом ведут себя на раскаленной поверхности и аммонийные удобрения, лишь вскипание у них выражено менее четко.
Открытие мочевины. Мочевина реактивами непосредственно не обнаруживается. Быстрым, но недостаточно точным способом обнаружения мочевины является «проба на раскаленную поверхность» - брошенная в нагретую фарфоровую чашечку мочевина «вскипает», дымит и дает резкий запах аммиака. Однако аналогичным образом ведут себя на раскаленной поверхности и аммонийные удобрения, лишь вскипание у них выражено менее четко.
Более точный метод обнаружения мочевины – реакция на биурет. Щепотку мочевины помещают в сухую пробирку и нагревают на плитке до появления и явного выделения аммиака. При этом мочевина превращается в биурет.

 N Н2 N Н2
N Н2 N Н2
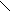
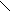 С = О С = О
С = О С = О
 |
N Н2 ® N Н + N Н3
 +
+
N Н2
 |
С = О С = О
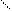 | 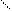 |
N Н2 N Н2
мочевина биурет
Биурет окрашивается следующим образом: в пробирку с образовавшимся биуретом после ее остывания приливают немного едкой щелочи, тщательно перемешивают легким встряхиванием и добавляют несколько капель слабого раствора медного купороса. Появляется сиреневая окраска.
|
из
5.00
|
Обсуждение в статье: РАСПОЗНАВАНИЕ УДОБРЕНИЙ ПО ХИМИЧЕСКИМ РЕАКЦИЯМ. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

