 |
Главная |
Основы теории электролитической диссоциации
|
из
5.00
|
Электролитами называются вещества, водные растворы или расплавы которых проводят электрический ток, неэлектролитами – вещества, водные растворы или расплавы которых не проводят электрический ток.
Электролитическая диссоциация – процесс распада атомов или молекул электролита на ионы при растворении его в воде или расплавлении[1].
Электролиты (по степени диссоциации)
| Сильные (α = 30…100%): |
| Средние (α = 3…30%): |
| Слабые (α = 0…3%): |
| Щёлочи, сильные кислоты, растворимые соли: KOH, NaOH, Ba(OH)2, H2SO4, HNO3, Na2SO4, MgCl2, CuSO4 и др. |
| Малорастворимые в воде основания, кислоты, соли: Ca(OH)2, Ag2SO4, PbCl2 и др. |
| Нерастворимые в воде основания, кислоты, соли, бинарные соединения, амфотерные гидроксиды, оксиды и т. д.: Mg(OH)2, Fe(OH)2, Fe(OH)3, Al(OH)3, Zn(OH)2, H2CO3, H2SiO3 и др. |
Степень диссоциации, α – отношение числа диссоциированных молекул (N) к общему числу молекул (N 0) электролита, находящихся в растворе:
α = N / N 0
Различают истинную (α(ист)) и кажущуюся (α(каж)) степень диссоциации. Кажущаяся степень диссоциации всегда меньше истинной. Кажущуюся степень диссоциации можно определить из соотношения:

где i – изотонический коэффициент раствора (определение будет дано в других статьях);
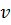 – общее число ионов в растворе, определяется из выражения:
– общее число ионов в растворе, определяется из выражения:

где 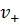 и
и  – количество катионов и анионов, составляющих электролит, соответственно.
– количество катионов и анионов, составляющих электролит, соответственно.
Степень диссоциации электролита зависит от следующих факторов:
· природаэлектролита – главный фактор, определяющий степень диссоциации; чем более полярной является химическая связь между атомами или группами атомов в молекуле, тем сильнее растворитель с высоким значением диэлектрической проницаемости (ДП) препятствует электростатическому взаимодействию ионов противоположного знака в растворе, следовательно, больше степень диссоциации электролита;
· природа растворителя – степень диссоциации в значительной мере зависит от диэлектрической проницаемости (ε) растворителя: чем больше диэлектрическая проницаемость среды, тем больше степень электролитической диссоциации;
· температура – для многих электролитов существует достаточно широкий температурный интервал, в котором наблюдается простая зависимость между тепловым эффектом, степенью диссоциации и температурой; если процесс диссоциации экзотермичен, то с повышением температуры степень диссоциации падает, а при эндотермическом процессе – повышение температуры ведёт к увеличению степени диссоциации;
· концентрацияраствора – степень диссоциации электролита при разбавлении раствора увеличивается;
· присутствиеодноимённыхионов – при прибавлении в раствор слабой кислоты или основания соли, содержащей одноимённый анион или катион для кислоты или основания соответственно, то согласно принципу Ле-Шателье, равновесие диссоциации будет смещено влево, т. е. в сторону уменьшения степени диссоциации.
Подавление диссоциации под влиянием одноимённого иона называется репрессией ионизации. С репрессией ионизации связаны многие процессы, имеющие практическое значение, например этот процесс используют для уменьшения растворимости тех или иных соединений.
Реакция электролитической диссоциации для всех электролитов является обратимой, а это означает, что в системе «вода - электролит» устанавливается химическое равновесие (подробнее о химическом равновесии ждите следующих видео на канале «Физикохимия»):
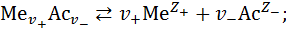
где  и
и  – зарядовые числа ионов определённого вида.
– зарядовые числа ионов определённого вида.
Константой такого равновесия будет служить величина, которая называется константой диссоциации электролита (Kд). По закону действующих масс (а он справедлив всех видов термодинамического равновесия в химических системах) константа диссоциации – постоянная величина, характеризующая электролит, равная отношению произведения равновесных концентраций диссоциированных ионов, взятых в степенях, равных числу ионов определённого вида, к молярной концентрации этого электролита:

Константа диссоциации зависит только от температуры, природы электролита и природы растворителя, НО не зависит от концентрации электролита/ионов в растворе.
Константа диссоциации более характерна для слабых электролитов и электролитов средней ионной силы, потому что сильные электролиты обладают значением константы диссоциации, приближающимся к единице.
Чем меньше Kд, тем слабее электролит проявляет способность к диссоциации.
Константа диссоциации для многоосновных кислот и многокислотных оснований уменьшается на второй, третьей и последующих ступенях диссоциации, так как отрыв протона от молекулы электролита требует гораздо большей энергии. Константа полной диссоциации слабого электролита равна произведению констант его диссоциации по ступеням:

где Kд – константа полной диссоциации слабого электролита;
 – константа определённой i-й ступени диссоциации данного электролита.
– константа определённой i-й ступени диссоциации данного электролита.
По закону разбавления Оствальда константа диссоциации электролита прямо пропорциональна квадрату его степени диссоциации:

где Cm – молярная концентрация электролита, 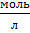 .
.
Таким образом, закон разбавления Оствальда гласит: степень диссоциации электролита при разбавлении раствора увеличивается.
Для слабых электролитов (α ≪ 1) знаменателем в уравнении константы диссоциации можно пренебречь, и получится, что степень диссоциации слабого электролита обратно пропорциональна квадратному корню из его концентрации:

Рассмотрим механизм электролитической диссоциации на примере молекулы бромида калия KBr.
Кристаллы KBr имеют ионную кристаллическую решётку, а это значит, что в узлах этой решётки расположены положительно заряженные ионы калия K(+) и отрицательно заряженные бромид-ионы Br(-). Каждый ион, находящийся на поверхности кристалла, образует вокруг себя электрическое поле. Влияние полей, созданных каждым зарядом в отдельности, распространяется на некоторое расстояние от кристалла KBr. В водном растворе кристалл со всех сторон окружён беспорядочно движущимися молекулами воды, которые, попадая в поле действия заряженных ионов, изменяют свое движение: в непосредственной близости от кристалла и ориентируются таким образом, что к отрицательно заряженному иону Br(-) диполи воды оказываются направленными положительно заряженным полюсом, а к положительно заряженному иону K(+) – отрицательно заряженным полюсом. Такое явление называется поляризацией молекул в электрическом поле, а молекулы воды при этом называются диполями (система одинаковых по модулю, разноимённых электрических зарядов; расстояние между этими зарядами называется плечом диполя l). Между ионами и диполями воды действуют кулоновские силы притяжения. В результате ион-дипольного взаимодействия выделяется энергия, способствующая разрыву ионных связей в кристалле и проведению иона из кристалла в раствор. Отделенные друг от друга ионы (диссоциированные) вплотную окружают полярные молекулы воды; такие ионы называются гидратированными. Явление взаимодействия ионов с молекулами воды, в результате чего происходит образование гидратной оболочки, называется гидратацией ионов. Гидратированные ионы, имеющие противоположные заряды, могут взаимодействовать друг с другом. Но так как ионы движутся в растворе вместе с гидратными оболочками, то сила их взаимодействия значительно уменьшена, и они способны к самостоятельному существованию.
Выше описанный механизм электролитической диссоциации закреплён в теории электролитической диссоциации Сванте Аррениуса. <фото С. Аррениуса>
В соответствии с ТЭД С. Аррениуса приведу определения классов неорганических соединений.
Кислоты – сложные вещества, при диссоциации которых в водных растворах в качестве катионов отщепляются (элиминируют) только катионы H(+). Многоосновные кислоты диссоциируют ступенчато: сначала образуется сложный кислый анион, а затем от этого аниона отщепляются последовательно оставшиеся ионы водорода:
H3PO4 ↔ H(+) + H2PO4(-);
H2PO4 ↔ H(+) + HPO4(2-);
HPO4(-) ↔ H(+) + PO4(3-)
Суммарное уравнение диссоциации:
H3PO4 ↔ 3H(+) + PO4(3-)
Основания – сложные вещества, при диссоциации которых в водных растворах отщепляются только гидроксид-ионы OH(-). Сложные основания так же, как и кислоты, диссоциируют ступенчато.
Fe(OH)3 ↔ Fe(OH)2(+) + OH(-);
Fe(OH)2(+) ↔ FeOH(2+) + OH(-);
FeOH(2+) ↔ Fe(3+) + OH(-)
Суммарное уравнение диссоциации:
Fe(OH)3 ↔ Fe(3+) + 3OH(-)
Соли – сложные вещества, которые в водных растворах диссоциируют на катионы металлов Me(n+) и анионы кислотных остатков Ac(m-).
Ag2SO4 ↔ 2Ag(+) + SO4(2-)
При растворении кислых солей в растворе образуются катионы металла Me(n+) и сложные анионы кислотного остатка, а также ионы, являющиеся продуктами диссоциации этого сложного кислотного остатка, в том числе H(+).
NaHCO3 ↔ Na(+) + HCO3(-);
HCO3(-) ↔ H(+) + CO3(2-)
При диссоциации основных солей образуются анионы кислотного остатка и сложные катионы, состоящие из иона металла Me(n+) и гидроксильных групп OH(-). Эти сложные катионы также способны к диссоциации. Поэтому в растворе основной соли присутствуют OH(-):
(CuOH)2CO3 ↔ CuOH(2+) + CO3(2-);
CuOH(2+) ↔ CuOH(+) + OH(-);
CuOH(+) ↔ Cu(2+) + OH(-)
Характер электролитической диссоциации той или иной молекулы в значительной степени определяется полярностями ее валентных связей. Полярность связи водорода с кислородом в соединениях типа R–O–H существенно меняется в зависимости от химической природы радикала R.
|
из
5.00
|
Обсуждение в статье: Основы теории электролитической диссоциации |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

