 |
Главная |
Урок 2. Тема. Синтетические волокна
|
из
5.00
|
Цель урока: 1. Обобщить и углубить знания учащихся о волокнах, их классификации, строении, свойствах. Ввести понятие синтетических волокон.
Научить записывать в общем виде уравнения получения синтетических волокон 3. Научить учащихся сравнивать, обобщать, высказывать суждение о свойствах веществ на основе их строения.
Тип урока: лекция.
Ход урока
I. Подготовка к восприятию нового материала.
Фронтальная беседа.
1. Как классифицируют волокна?
2. Какие вы знаете волокна? Каковы их свойства? Где они применяются?
II. Изучение нового материала.
1. Кратко о классификации волокон.
Демонстрация: «Коллекция волокон», «Образцы синтетических волокон».
2. Синтетическое волокно – лавсан: объяснить его название, сырьё, свойства и применения.
3. Синтетическое волокно – капрон: сырьё, свойства и применения.
III. Закрепление новых знаний.
1.Задание на дом.
Записи в тетради, упражнения 1-2, подготовка к практической работе.
Для практической работы перечертить таблицу, только написать полиэтилен, поливинилхлорид, фенол-формальдегидные смолы, капрон, полистирол. Для волокон – таблица, выписать хлопок, шерсть, лавсан, капрон.
2.Фронтальная беседа:
Самостоятельная работа по карточкам (на 10 мин.) по одному вопросу.
Карточка №1. Широко распространённый полимер полихлорвинил (поливинилхлорид) имеет строение:

Найдите структурное звено полимера и определение структурную формулу мономера.
Карточка №2. Какими признаками должны характеризоваться вещества, вступающие в реакции: а) полимеризации; б) поликонденсации? Приведите примеры.
Карточка №3. Опишите свойства полиэтилена и полипропилена. Где они применяются?
Урок 3. Тема. Распознание пластмасс и химических волокон.
Тип урока: Практическая работа
Цель урока: 1. Закрепить и углубить знания учащихся о пластмассах и химических волокнах. 2.Научить умению определять пластмассы и химические волокна, соблюдать правила по технике безопасности при работе с органическими веществами.
Ход урока
I. Подготовка к выполнению практической работы.
1. Беседа учителя о правилах по технике безопасности при работе с органическими веществами. 2. Порядок выполнения работы (беседа).
II. Проведение практической работы.
Для проведения практической работы использовать, свои таблицы и практическую работу, в учебнике для 11 класса [1].
Распознавание пластмасс следует начать с внешнего осмотра, а затем перейти к исследованию их отношения к нагреванию и горению. Потом испытывают действие на них растворителей.
Распознавание волокон начинают с их сжигания. При этом прослеживают, с какой скоростью происходит горение, исследуют запах продуктов разложения, свойства остатка, который образуется после горения. Затем проверяют действие на волокна кислот, щелочей и растворителей.
Например, в отдельных пакетах под номерами разложены разные пластмассы: № 1– поливинилхлорид; № 2 – полиэтилен; № 3 – полистирол; № 4 – фенол-формальдегидная пластмасса; №5 –капрон. В других пакетах под номерами – образцы волокон: № 1 – шерсть; № 2- хлопок; № 3 – вискоза; № 4 – ацетатное волокно; № 5 – лавсан. Учащиеся берут из каждого пакета образцы волокон и пластмасс и исследуют их (по продуктам сжигания, действию кислот, щелочей и т. д.). После определения данного образца они ставят соответствующий номер в своей таблице.
2. Приведение в порядок своего рабочего места. Выводы по работе, необходимые записи.
III. Закрепление знаний, умений, навыков.
Подготовка к следующей теме.
Задачи
Важную роль в процессе подготовки к экзамену по химии играют задачи. Их решение способствует неформальному усвоению теоретического курса. Они включаются в экзаменационные билеты. При этом мы будем рассматривать некоторые наиболее типовые задачи с решениями [5, 11, 12].
1. Углеводород А, который легче воздуха, присоединяет в присутствии хлорида ртути (II) хлороводород и превращается при этом в вещество В, которое при определенных условиях образует вещество С, имеющее тот же качественный и количественный состав, но гораздо большую относительную молекулярную массу. Приведите формулы веществ А, В, С. Напишите уравнение реакций.
Ответ : A - C2H2,, B - CH2=CHCl, C - (-CH2-CHCl-)n .
2. Составьте уравнение реакции полимеризации углеводорода C 4 H 8 с разветвленным углеродным скелетом.
Ответ : n(CH3)2C = CH2→(-CH2-C(CH3)2-)n .
3. Напишите уравнение между бутадиеном и стиролом, приводящее к образованию полимера регулярного строения.
Ответ : nC6H5CH = CH2+nH2C = CH-CH = CH2→(-CH2-CH(C6H5)-CH2-CH=
= CH - CH 2 -) n .
4. Исходя из неорганических веществ, получите полимер с четырьмя атомами углерода в элементарном звене.
Ответ: CaO → CaC 2 → C 2 H 2 → HC º C - CH = CH 2 → H 2 C = CH - CH =
= CH 2 →(- CH 2 CH = CHCH 2 -) n .
4. Предложите способы получения из этанола двух полимеров с разным числом атомов углерода в элементарном звене.
Ответ: 1) C 2 H 5 OH → C 2 H 4 →(- CH 2 - CH 2 -) n ;
2) C2H5OH→H2C = CH-CH = CH2→(-CH2-CH = CH-CH2-)n .
5. Органическое стекло представляет собой полимер метилового спирта метакриловой кислоты – простейшей непредельной карбоновой кислоты с разветвленным скелетом. Напишите уравнение реакции образования оргстекла.
Ответ : nCH2 =  -COOCH3→
-COOCH3→ 
7. Какую массу каучука можно получить из 100 кг. 96%-ного этанола, если выход реакции Лебедева составляет 60%, а реакции полимеризации – 80%?
Ответ: 27 кг. каучука.
8. Определите среднюю степень полимеризации в образце бутадиенового каучука, средняя молярная масса которого равна 100000 г/моль. Изобразите структуру мономерного звена.
Ответ: 1850.
9. Сравните массовые доли углерода в полимере и мономере, если полимер получен в результате реакции: а) полимеризации;
б) поликонденсации с выделением воды. Ответ мотивируйте.
Ответ: а) массовые доли одинаковы;
б) в полимере массовая доля углерода больше.
10. Определите строение непредельного углеводорода с открытой цепью углеродных атомов, на полное каталитическое гидрирование 1,62 г. которого потребовалось 1,34 л. водорода (н.у.). Исходный углеводород широко используется в промышленности для производства каучука.
Ответ: бутадиен-1,3.
11. К 1,12 л. бесцветного газа (н.у.), полученного из карбида кальция, присоединили хлороводород, образовавшийся при действии концентрированной серной кислоты на 2,93 г. поваренной соли. Продукт присоединения хлороводорода полимеризовался с образованием 2,2 г. полимера. Какой полимер был получен? Каков выход превращения мономера в полимер (в % от теоретического)?
Ответ: 70,4% поливинилхлорида.
12. Определите среднюю степень полимеризации в образце природного каучука, средняя молярная масса которого равна 200 000 г/моль. Изобразите структуру мономерного звена.
Решение:
Природный каучук представляет собой полиизопрен, в котором большинство звеньев находится в цис-конфигурации. Получение каучука из изопрена можно представить как 1,4-присоединение:
 .
.
Каждое мономерное звено имеет молекулярную формулу С5Н8 и молярную массу 68 г/моль. В одной молекуле полимера в среднем содержится 200 000 /68=2940 мономерных звеньев.
Ответ: Степень полимеризации – 2940.
13. 28,2 г. фенола нагрели с избытком формальдегида в присутствии кислоты. При этом образовалось 5,116 г воды. Определите среднюю молярную массу полученного высокомолекулярного продукта реакции, считая, что поликонденсация протекает только линейно и фенол полностью вступает в реакцию.
Решение:
Уравнение линейной поликонденсации фенола и формальдегида можно записать следующим образом:


 OH
OH






 n +(n+1)CH2O
n +(n+1)CH2O 










 OH OH OH
OH OH OH
















 CH2 CH2
CH2 CH2








 +(n-1)H2O
+(n-1)H2O
n-2
Согласно этому уравнению отношение количеств воды и фенола равно (n-1)/n, что позволяет найти значение n. Количество веществ v ( C 6 H 5 OH )= =28,2/94=0,300 моль, v ( H 2 O )=5,116/18=0,2842 моль.
v(H2O)/ v(C6H5OH)=0,2842/0,300=(n-1)/n,
откуда п =19. Молярная масса продукта конденсации равна:
M=M(C6H4OH)+17. M(CH2C6H3OH)+M(CH2C6H4OH)=
=93+17.106+107=2002 г/моль.
Ответ: 2002 г/ моль.
14. Сколько тонн 2-метил-1,3-бутадиена можно получить из 180 тонн 2-метил-бутана, если выход продукта составляет в массовых долях 0,89, или 89%, по сравнению с теоретическим?
Решение:

Ответ: 151,3 m 2-метил-1,3-бутадиена.
15. Сколько по объему 1,3-бутадиена можно получить из 800 л. раствора содержащего в массовых долях 0,96, или 96% этилового спирта (  г/см3)?
г/см3)?
Решение:

Ответ: 149,6 м3 бутадиена.
16. Составьте уравнение реакций, при помощи которых можно осуществить следующие превращения:

Ответ:
1) 
2) 
3) 
поливинилхлорид
17. Напишите уравнения реакций, при помощи которых можно осуществить следующие превращения и назовите продукты реакции:

Ответ:
1) 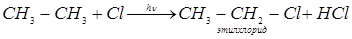
2) 
3) 
4) 
5) 
18. При полимеризации 140г изобутилена в присутствии серной кислоты был получен диизобутилен. Непрореагировавший изобутилен отогнали, а на диизобутилен подействовали бромом, причем было израсходовано 120г брома. Определите процент выхода диизобутилена.
Ответ: 60%.
19. Определите среднюю степень полимеризации в образце хлоропренового каучука, средняя молярная масса которого равна 120 000 г/моль. Изобразите структуру мономерного звена этого полимера.
Решение. Хлоропрен по строению напоминает изопрен, имея атом хлора на месте метильной группыизопрена. Полимеризация хлоропрена в положения 1,4 дает полимер:

n CH2=C–CH=CH2 → –CH2–C=CH–CH2–
| |
Cl Cln
хлоропрен
Хлоропреновый каучук
Структура мономерного звена:
–СН2−С=СН−СН2−
|
Сl
Молярная масса М (C4H5Cl)= 88,5 г/моль. Средняя степень полимеризации n = M (каучука)/ М (мономера) = 120000 : 88,5 = 1356.
Ответ. n=1356. [16,20, 21]
Тесты
1) К природным высокомолекулярным соединениям относится:
а. полиэтилен
б. глюкоза
в. сахароза
г. клетчатка (+)
2) Белковые молекулы из аминокислот образуются по реакции.
а. замещения
б. поликонденсации (+)
в. полимеризации
г. разложения
3) Какому классу синтетических высокомолекулярных соединений родственны в химическом отношении белки?
а. полиолефинам
б. поликарбонатам
в. полиамидам (+)
Г. полиэфирам
д. полиуретанам
4) Процесс соединения одинаковых молекул в более крупные молекулы:
а. поликонденсация
б. изомеризация
в. полимеризация (+)
г. гидратация
5). Структурным звеном полиэтилена является:
а. CH3-CH=CH2
б. –CH2–CH2– (+)
в. –CH–CH2–
|
СН3
г. СH2=CH2
6). Полиэтилен получают, используя реакцию
а. полимеризации (+)
б. поликонденсации
в. гидрирование
г. изомеризации
7). Элементарным звеном бутадиенового каучука является:
а.–CH2–CH=CH–CH2– (+)
б. CH2=CH–CH=CH2
в. –CH2–CH2–CH2–CH2–
г.–CH2–CH2–
8). Элементарное звено – CH 2 – CH 2 – имеется в макромолекулах:
а. бутадиенового каучука
б. полиэтилена (+)
в. полипропилена
г. бутадиенстирольного каучука
9). Высокомолекулярные соединения получают в результате:
а. гидролиза и этерификации
б. этерификации и поликонденсации
в. полимеризации и поликонденсации (+)
г. полимеризации и гидролиза
10). К биополимерам относятся:
а. белки (+)
б. капрон
в. натуральный каучук (+)
г. полистирол
д. сахароза
11). Структурное звено полипропилена:
а. CH3–CH=CH2
б. –CH2–CH2–
в. –CH–CH2– (+)
|
СН3
г.CH2=CH2
12). Полиэтилен получают реакцией полимеризации:
а. бутена
б. этана
в. изопропена
г. этена (+)
13). Элементарное звено – CH 2 − CH = CH − CH 2 − имеется в макромолекулах:
а. полиэтилена
б. бутадиенового каучука (+)
в. бутадиенстирольного каучука
г полистирола
14). Каучук получают, используя реакцию
а. этерификации
б. дегидрирование
в. «серебряного зеркала»
г. полимеризации (+)
д. поликонденсации
15). Формула мономера для получения полипропилена
а. CH3−CH=CH2 (+)
б. CH2=CH2
в. –CH-CH2
|
СН3
г.CH2=CH−CH=CH2
16). Какие полимеры обладают термопластичностью:
а. полистирол (+)
б. фенолформальдегидная смола
в. карболит
г. полиэтилен (+)
17). Мономер для получения полиэтилена:
а. CF2=CF2
б. CН2=CH−СН3
в.CH2=CH2 (+)
г.-CH2-CH2-
18). В результате реакции поликонденсации может образоваться:
а. полипропилен
б. полистирол
в. бутадиенстирольный каучук
г. фенолформальдегидная смола (+)
19). Первичные спирты могут использоваться:
а. в процессе крекинга
б. в реакциях полимеризации (+)
в. для получения сложных эфиров
г. для синтеза углеводов
20). Как называется процесс получения резины из каучука при нагревании его с серой:
а. поликонденсация
б. вулканизация (+)
в. окисление
г. гидрирование
21). Полимер, имеющий следующее строение
 Н СН3
Н СН3
\ ∕
С=С
∕ \
 –СН2 СН2– n
–СН2 СН2– n
Смешали с избытком серы и нагрели. Продукт реакции называется:
а. резина
б. стирол
в. эбонит (+)
г. изопреновый каучук
22). Для того чтобы началась реакция полимеризации, к мономеру добавляют пероксид водорода. Какую роль выполняет пероксид водорода?
а. катализатора
б. ингибитора
в. инициатора (+)
г. индикатора
23). Сырьем для промышленного производства ацетатного волокна служит:
а. целлюлоза (+)
б. натуральный каучук
в. лавсан
г. поливинилхлорид
24). Полимеризацией, какого вещества получают волокно капрон:
а. ацетилена
б. винилхлорида
в. капролактама (+)
г. 6-аминогексановой кислоты
25). Какое из данных веществ является полиэфирным волокном:
а. целлюлоза
б. лавсан (+)
в. ацетатное
г. хлопковое
26). К каким волокнам относится вискозное волокно:
а. растительного происхождения
б. синтетическим
в. животного происхождения
г. искусственным (+)
27). В чем растворяется натуральный шелк:
а. NaOH (10%) (+)
б. NaOH (5%)
в. HCl
г. ацетоне
28). Какую реакцию дают продукты разложения хлопка:
а.окрашиваются в желтый цвет
б. окрашивают синюю лакмусовую бумажку в красный цвет (+)
в. набухают
г. обесцвечивают раствор KMnO4
29). В чем не растворяется целлулоид:
а. бензоле (+)
б. феноле
в. HNO3
г. дихлорэтане (+)
30). Сополимеризацией каких веществ получают бутадиенстирольный каучук:
а. стирола и метилметакрилата
б. фенола и формальдегида
в.1,3-бутадиена и стирола (+)
г. этиленгликоля и терефталевой кислоты
31).Укажите название высокомолекулярных веществ природного про исхождения:
а) крахмал +
б) полиэтилен
в) глюкоза
г) целлюлоза +
32). Какое волокно содержит амидную связь:
а) лавсан
б) ацетатное +
в) капрон
г) хлопковое
33). Натуральный каучук представляет собой:
а) цис- форму полибутадиена
б) транс- форму полиизопрена
в) транс- форму полибутадиена
г) ) цис- форму полиизопрена +
34). Чему равна степень полимеризации полипропилена со средней мо лярной массой 100000 г/моль?
а) 2300
б) 2375
в) 2381 +
г) 2392
35). Какие из перечисленных волокон относятся к химическим?
а) хлопковое
б) вискозное +
в) лавсан +
г) шерстяное
36). Какие два вещества из перечисленных ниже взаимодействуют между собой с образованием мономера, используемого для получения волокна лавсан:
а) этиленгликоль +
б) глицерин
в) бензойная кислота
г) терефталевая кислота +
37). К синтетическим волокнам относятся:
а) льняное
б) лавсан +
в) капрон +
г) ацетатное
38). Укажите массовую долю хлора в поливинилхлориде (%):
а) 55,8
б) 56,8 +
в) 57,0
г) 58,8
39). Какой каучук называют дивиниловым:
а) изопреновый стереорегулярного строения
б) изопреновый с транс- формой макромолекул +
в) бутадиеновый стереорегулярного строения
г) бутадиеновый нерегулярного строения +
40).Волокно капрон представляет собой:
а) продукт реакции полимеризации аминокапроновой кислоты
б) продукт реакции сополимеризации этиленгликоля и терефталевой кислоты
в) продукт реакции поликонденсации 6- аминогексановой кислоты +
г) продукт реакции поликонденсации γ- аминокапроновой кислоты
41).Какой каучук получается при полимеризации 2- хлорбутадиена- 1,3?
а) дивиниловый
б) изопреновый
в) хлоропреновый +
г) бутадиеновый
42).Охарактеризуйте процесс вулканизации каучука
а) повышает прочность каучука +
б) является химическим процессом +
в) является физическим процессом
г) для этой цели используется сера +
43).Для получения искусственного волокна целлюлозу:
а) взаимодействием с хлором
б) взаимодействием с хлороводородом
в) обрабатывают азотной кислотой
г) обрабатывают уксусным ангидридом +
44).Сколько изопреновых звеньев должна содержать макромолекула натурального каучука при молярной массе, равной одному миллиону?
а) 16700
б) 15700
в) 14700 +
г) 14800
45).Средняя относительная молекулярная масса целлюлозы равна 586602. Рассчитайте степень поликонденсации макромолекулы:
а) 3550
б) 3601
в) 3621 +
г) 3653 [22]
3.4 Тесты с экологическим содержанием
1. Соединение, образующееся при сгорании ВМС, приводящее к образованию сернистой кислоты:
а) 
б) 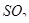 +
+
в) 
г) 
2. Основные вещества, которые загрязняют и ухудшают качество природных вод:
а) нефтепродукты +
б) фенолы +
в) соединения углерода (карбонаты, гидрокарбонаты)
г) фенолформальдегидные смолы +
д) соединения кремния (кремнезем, силикаты)
3. Высокомолекулярные природные соединения, служащие структурными частями живых организмов и играющие важную роль в процессах жизнедеятельности:
а) ксенобиотики
б) ДНК +
в) жиры
г) биополимеры +
4. Искусственный загрязнитель атмосферного воздуха:
а) морские (кристаллы соли)
б) внеземные (космическая пыль)
в) сжигание ископаемого топлива (торф, уголь, нефть) +
г) континентальные (выветривание, вулканы)
5. Процесс расщепления углеводов отсутствии кислорода, конечным продуктом которого является молочная и пировиноградная кислота:
а) пиролиз
б) электролиз
в) гликолиз
г) гидролиз +
6. Биохимический процесс превращения продуктов разложения органических остатков в высокомолекулярные вещества при участии микроорганизмов:
а) гумификация
б) мутация
в) гипертония
г) эвтрофикация +
7. Приемы правильной утилизации полимерных отходов:
а) сжигание
б) сбор полимерных отходов и их закапывание +
в) вторичная переработка +
г) выбрасывание на свалку
8. Для очистки моря от загрязнения нефтью применяют:
а) каучуковые гранулы из старых автомобильных шин +
б) пемзогранулы
в) древесный уголь
г) керамзитовые гранулы
9. При горении высокомолекулярных соединений образуются токсичные продукты:
а) хлорвинил +
б) диоксины +
в) аммиак
г) водяные пары
д) угарный газ
10. Термореактивные полимеры не подлежат вторичной переработке, так как:
а) не сохраняют способности вновь переходить в вязкотекучие при повторном нагревании +
б) при их нагревании выделяются ядовитые вещества
в) не растворяются в воде
г) полимер «стареет»
11. Высокомолекулярные соединения, содержащиеся в ядрах клеточных организмов, являющиеся носителем генетической информации6
а) РНК
б) ДНК +
в) АТФ
г) рибосома
12. Сложный белок, содержащий небелковый компонент:
а) протеид +
б) протеин
в) витамин
г) пигмент
13. Белок, образующийся из другого сложного белка плазмы крови под действием фермента ромбина:
а) фибрин +
б) фибропласт
в) фитоцид
г) фитотрон
14. Высокомолекулярное органическое вещество почвы, образующееся в результате гумификации органических остатков:
а) фульвокислоты
б) ульмин
в) гумин
г) гумус +
15. В клетках животных и человека глюкоза:
а) является источником энергии +
б) выполняет запасающую функцию
в) участвует в процессе фотосинтеза
г) является катализатором
16. Конечным продуктом гидролиза крахмала является:
а) сахароза
б) глюкоза +
в) целлюлоза
г) этанол
17. При гидролизе сахарозы образуется:
а) глюкоза и фруктоза +
б) крахмал
в) глюкоза и этанол
г) целлюлоза
18. Высокомолекулярные соединения образуются в результате реакции:
а) гидролиза и этерификации
б) этерификации и поликонденсации
в) полимеризации и поликонденсации +
г) полимеризации и гидролиза
19. При производстве и использовании ДСП в окружающую среду выделяется:
а) аммиак и углекислый газ
б) фенол и формальдегид +
в) этанол и вода
г) угарный газ и метан
20. Основной поставщик фенола и формальдегида в атмосферу:
а) медицина
б) деревообрабатывающая промышленность +
в) химическая промышленность +
г) пищевая промышленность
21. ПДК фенола в воздухе:
а) 1 мг/м3
б) 20 мг/м3
в) 17 мг/м3
г) 5 мг/м3 +
22 ПДК фенола в сточных водах:
а) 20 мг/м3
б) 1-2 мг/м3 +
в) 12 мг/м3
г) 4 мг/м3
23. Один из отходов при производстве фенолформальдегидных смол:
а) ацетон
б) кумол
в) фенольная смола +
г) метиловый спирт
24. Один из методов утилизации ПВХ:
а) гидролиз
б) газификация
в) гомогенное горение
г) окислительное щелочное разрушение +
25. Одно из наиболее опасных соединений, которое выделяется при горении ДСП:
а) циановодород +
б) серная кислота
в) азотная кислота
г) бензапирен [23]
| Количество выполненных заданий (в %) | Оценка |
| 35 | неудовлетворительно |
| 50 | удовлетворительно |
| 70 | хорошо |
| 100 | отлично |
Вопросы
1. Какие вещества называют высокомолекулярными? Приведите примеры.
2. В результате, каких реакций получают высокомолекулярные соединения?
Ответ. Высокомолекулярные соединения можно получать с помощью реакций полимеризации, поликонденсации, полиприсоединения.
3. Чем отличаются реакции полимеризации и поликонденсации?
4. Какого значение высокомолекулярных веществ?
5.Какие реакции называют реакциями полимеризации? Напишите уравнение реакции полимеризации пропилена.
Ответ. Полимеризация – это процесс соединения большого числа одинаковых молекул (мономеров) в одну большую молекулу (полимер). 6.Могут ли образовывать полимеры галогенпроизводные непредельных углеводородов?
Ответ: Да, могут. Например, галогенпроизводное ацетилена – винилхлорид способен полимеризоваться:
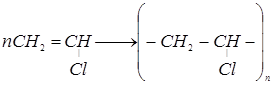
винилхлоридполивинилхлорид
При полимеризации тетрафторэтилена  образуется политетрафторэтилен (- CF 2 - CF 2 ) n .
образуется политетрафторэтилен (- CF 2 - CF 2 ) n .
7. Как ученым удалось выяснить строение макромолекул природного каучука?
Ответ: При нагревании без доступа воздуха натуральный каучук распадается с образованием 2- метил-1,3- бутадиена (изопрена). Это означает, что молекулы натурального каучука построены из фрагментов молекул изопрена
8. Каковы физические и химические свойства природного каучука?
Ответ. Физические свойства: природный каучук – упругое аморфное вещество, очень эластичен, водогазонепроницаем, не растворяется в воде, растворяется в бензине, хлороформе и сероуглероде.
Химические свойства: натуральный каучук – непредельное соединение и способен к реакциям присоединения. В частности, он реагирует с серой, атомы которой сшивают вместе различные полиизопреновые цепи.
9. Чем отличаются каучуки от резины?
Ответ. Резина – это продукт реакции каучука с серой. Она обладает значительно большей прочностью, но меньшей эластичностью, чем каучук.
10. Напишите уравнение реакции полимеризации 1,3 – бутадиена:
nCH2=CH-CH=CH2→(-CH2-CH=CH-CH2)n
11. Напишите уравнение реакции получения поливинилхлорида из ацетилена:
Ответ : CH=CH+HCL→CH2=CHCL
12. Перечислите области применения формальдегида. На каких свойствах основано его использование?
Ответ. Важнейший из альдегидов - формальдегид – применяется для получения фенолформальдегидной смолы и пластмасс на ее основе. В основе этого процесса – реакция поликонденсации фенола с формальдегидом.
13. Что такое фенопласты?
Ответ. Фенопласты – это пластмассы, изготовленные из фенолформальдегидной смолы в сочетании с различными наполнителями.
14. Как образуется целлюлоза в природе? Составьте соответствующие уравнение реакций.
Ответ. Целлюлоза образуется в результате реакций фотосинтеза:
6 CO2+6H2O→C6H12O6+6O2
n C6H12O6→(C6H10O5)n+nH2O
15. Какие волокна получают из целлюлозы и чем они отличаются друг от друга?
Ответ. Из целлюлозы получат искусственные волокна: ацетатное и вискозное. Они отличаются химическим составом, ацетатное волокно- это триацетат целлюлозы [C6H7O2(OCOCH3)3]n, а вискозное – это просто определенным образом обработанная целлюлоза.
16. Какие элементы входят в состав белков? Охарактеризуйте строение белковых молекул.
Ответ. В состав всех белков входят углеводород, водород, кислород и азот. Большинство белков содержит также серу.
Белки – это природные полимеры, состоящие из остатков аминокислот, соединенных пептидными связями. Последовательность аминокислотных остатков называется первичной структурой белка. Полипептидная цепь скручена в пространстве в спираль за счет водородных связей между группами –NH и –CO-. Пространственная структура полипептидной цепи называется вторичной структурой. Трехмерная конфигурация закрученной спирали в пространстве, образованная за счет дисульфидных мостиков –S-S- между цистеиновыми остатками и ионных взаимодействий, называется третичной структурой.
17. Какие группы атомов и типы связей наиболее характерны для большинства белковых молекул?
Ответ. Во всех белковых молекулах есть пептидная связь –NH – CO- между аминокислотными остатками и водородные связи между группами –NH и –CO-.
В белках, в состав которых входит аминокислота цистеин, между различными фрагментами полипептидной цепи образуется дисульфидный мостик –S-S-.
18. Где белки встречаются в природе и каково их назначение?
Ответ. Белки – основной компонент клеток и тканей всех живых организмов. Значение белков состоит в том, что они являются катализаторами всех химических процессов в живых организмах.
19. Опишите физические и химические свойства белков.
Ответ. Физические свойства: глобулярные белки растворимы в воде или образуют коллоидные растворы; фибриллярные белки в воде не растворимы. Химические свойства. 1). Денатурация – разрушение вторичной и третичной структуры белка с сохранением первичной структуры. Происходит при нагревании или действии растворителей. 2). Гидролиз белков – разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
3). Качественная реакция на белки - красно – фиолетовое окрашивание при действии солей меди (II) в щелочном растворе (биуретовая реакция).
20. Как можно доказать наличие белков в продуктах питания, в шерстяных и шелковых тканях?
Ответ. Это можно доказать с помощью цветных качественных реакций, например биуретовой реакции.
21. Дайте общую характеристику роли белков в процессах жизнедеятельности человека и животных.
Ответ. В живых организмах белки играют роль строительного материала. Из них построены мышцы, части суставов, кожа, волосы. Другой тип белков – ферменты – играют роль катализаторов химических процессов в живых организмах. Кроме того, некоторые белки выполняют транспортные функции, перенося вещества из одной части организма в другую.
22. Какие вещества относятся к высокомолекулярным соединениям, а какие - к мономерам и полимерам? На конкретных примерах поясните, чем отличается строение их молекул.
Ответ. ВМС – это соединения с большой молекулярной массой. ВМС – полимеры, молекулы которых содержат повторяющиеся фрагменты. Полимеры получают путем соединения большого числа молекул мономеров. Например, полимер поливинилхлорид (-CH2-CHCL)n получают из мономера винилхлорида CH2=CHCL
23. Поясните, что такое «структурное звено» и «степень полимеризации».
Ответ. Структурное звено – это повторяющийся фрагмент в молекуле полимера. Например, в поливинилхлориде (-CH2-CHCL)n структурное звено - CH2 - CHCL. Число структурных звеньев в молекуле полимера называется степенью полимеризации.
24. На конкретном примере покажите возможность образования полимера со стереорегулярным и стереонерегулярным строением.
Ответ. При полимеризации пропилена получают полипропилен:
nCH2=CH-CH3 → (-CH2-CH-)n
|
СН3
Если в образующемся полимере группы – CH3 расположены хаотично по одну и другую сторону цепи, то это - стереонерегулярный полимер. Можно подобрать такие условия процесса полимеризации (в первую очередь катализатор), что группы – CH3 ,будут располагаться только по одну из сторон цепи или по обе стороны, но строго регулярно, В этом случае получится стереорегулярный полимер.
25. Охарактеризуйте процесс получения полиэтилена и полипропилена в промышленности. Составьте уравнения соответствующих реакций:
Ответ: полимеризацию этилена nCH2=CH2→(-CH2-CH2-)n
и пропилена nCH2=CH−СН3 →(-CH2-CH-)n
|
СН3
проводят при комнатной темпера
|
из
5.00
|
Обсуждение в статье: Урок 2. Тема. Синтетические волокна |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

