 |
Главная |
Группы веществ, применяемые для маскировки
|
из
5.00
|
В табл. 1 приведены важнейшие маскирующие лиганды, чаще всего применяющиеся в практике анализа. Действие некоторых приведенных в таблице лигандов основано на окислительно-восстановительных реакциях. Так, аскорбиновая кислота и некоторые другие восстановители применяются для маскирования железа (III) путем восстановления его до низшей степени окисления. Влияние других маскирующих лигандов обусловлено кислотно-основным взаимодействием. Это имеет большое значение, в частности, при маскировании оксикислотами, ЭДТА и ее производными, которые реагируют с очень большим числом различных элементов. Для лигандов подобного типа всегда можно добиться большей специфичности маскирования изменением рН раствора. Пример - связывание щелочноземельных металлов (Са, Sr и Ва) в устойчивые комплексные соединения в щелочной среде и их разрушение при подкислении.
Группы маскирующих веществ:
. Вещества, образующие с мешающими веществами более устойчивые соединения, чем с определяемыми. Например, образование комплекса Fe(III) с тиоцианат-ионом красного цвета можно предотвратить введением в раствор фторида натрия. Фторид-ионы связывают железо (III) в бесцветный комплекс 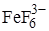 , более устойчивый, чем
, более устойчивый, чем 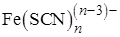 , что позволяет устранить мешающее влияние Fe(III) при обнаружении, например, Со(II) в виде комплекса синего цвета
, что позволяет устранить мешающее влияние Fe(III) при обнаружении, например, Со(II) в виде комплекса синего цвета 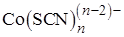 .
.
. Вещества, предотвращающие кислотно-основные реакции с образованием малорастворимых гидроксидов. Например, в присутствии винной кислоты гидрат оксида Fe(III) не осаждается аммиаком вплоть до рН 9-10.
. Вещества, изменяющие степень окисления мешающего иона. Например, для устранения мешающего влияния Сr(Ш) при комплексонометрическом титровании алюминия и железа рекомендуется его окислить до Cr(VI).
. Вещества, осаждающие мешающие ионы, но осадок при этом можно не отделять. Например, проводят комплексонометрическое титрование кальция в присутствии магния, который осаждают в виде гидроксида, но не отделяют.
. Вещества со специфическим действием. Например, полярографические волны подавляются в присутствии некоторых поверхностно-активных веществ (ПАВ).
Иногда маскирование сочетает указанные приемы. Например, ионы Cu(II) можно замаскировать цианид-, тиосульфат-ионами. При этом Cu(II) восстанавливается до Cu(I), а затем с избытком маскирующего вещества образует комплексы состава 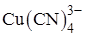 ,
, 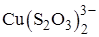 .
.
Винная кислота связывает железо и ряд других элементов в щелочной среде, но в кислых растворах утрачивает эту способность.
Успех маскирования, основанного на образовании комплексных соединений, зависит от правильного выбора соответствующего лиганда. Почти всегда мешающее определению вещество Y необходимо связать в как можно более устойчивое соединение. Чем выше устойчивость комплекса, тем лучший эффект маскирования наблюдается при прочих равных условиях,-Если известны константы устойчивости всех комплексов, образующихся в реакциях маскирования и определения, выбрать оптимальный вариант маскирования не представляет труда. Соответствующие приемы расчета описаны в последующих параграфах. Однако константы устойчивости до сих пор определены далеко не для всех комплексов металлов, участвующих во взаимодействии с R и L. Полезно иметь и методы, позволяющие, не прибегая к сложным расчетам, оценить качественно возможность или целесообразность маскирования посредством данного маскирующего лиганда. Такая качественная оценка возможна, в основе ее лежат два принципа, неоднократно обсуждавшиеся в литературе по химии координационных соединений.
Один из этих принципов состоит в качественной оценке устойчивости комплексов в зависимости от строения электронных оболочек катионов-комплексообразователей и, следовательно, от их положения в периодической системе Д.И. Менделеева. В литературе показано, что все катионы-комплексообразователи целесообразно разделить на три группы.
К первой группе относятся катионы с электронной конфигурацией типа инертных газов, содержащие во внешней оболочке два или восемь электронов. К ним относятся однозарядные катионы лития, натрия, калия, рубидия и цезия, двухзарядные катионы бериллия, магния, кальция, стронция и бария, трехзарядные катионы алюминия, скандия, иттрия и лантана, четырехзарядные катионы титана, циркония и гафния, а также катионы ниобия и тантала.
Строение внешней электронной оболочки центральных ионов-комп-лексообразователей сильно влияет на свойства образующихся координационных соединений. Катионы с двумя или восемью электронами во внешней электронной оболочке образуют комплексы со значительной долей электровалентной (ионной) связи. Устойчивость оболочек типа инертных газов обусловливает малую поляризуемость и малую деформацию внешних электронов при взаимодействии с различными лигандами. Поэтому катионы названного типа можно в первом приближении рассматривать как жесткие шарики с положительным зарядом в центре, взаимодействующие с лигандами в результате электростатического притяжения. Сила этого притяжения в соответствии с законом Кулона, а следовательно, и устойчивость комплексов определяются в основном зарядом и радиусом частиц. Полезной характеристикой является также объединенная величина - отношение заряда к радиусу, называемая ионным потенциалом, который характеризует интенсивность электрического поля вокруг данного иона.
Сформулированная зависимость дает возможность сделать вывод о степени маскирования катионов металлов теми или иными лигандами. Так, катионы алюминия должны лучше маскироваться фторид-ионами, чем катионы лантана, так как устойчивость фторидных комплексов возрастает от лантана к алюминию из-за уменьшения радиусов ионов в этом же ряду. Маскирующее действие ЭДТА усиливается по этой же причине при переходе от бария к кальцию. Аналогичное изменение устойчивости характерно для цитратных, тартратных, глицинатных компонентов щелочноземельных металлов.
Вторую группу ионов-комплексообразователей составляют катионы с недостроенным J-подуровнем. Здесь в меньшей степени применимы простые электростатические представления, основанные на законе Кулона. Такие электронные оболочки при действии электроотрицательных лигандов деформируются значительно больше, чем 8-электронные оболочки ионов, и доля ковалентности химической связи металл-лиганд сильно возрастает.
Изменение устойчивости комплексов элементов четвертого периода можно объяснить с позиций усовершенствованной электростатической теории - теории кристаллического поля. Имеют также значение размеры радиусов ионов. В этой группе ионов наибольший интерес представляет ряд устойчивости Ирвинга-Вильямса: устойчивость комплексов со многими лигандами увеличивается в такой последовательности: Mn(II) < Fe(II) < < Co(II) < Ni(II) < Cu(II) > Zn(II), в соответствии с чем можно предвидеть, что, например, аминоуксусная кислота лучше всего маскирует медь и в наименьшей степени - марганец. Аналогичные соотношения справедливы для 1 ДО-фенантролиновых или этилендиамин тетраацетатных комплексов меди и для комплексов названных в ряду металлов со многими другими лигандами.
В третью группу входят катионы, содержащие во внешней оболочке 18 или 18+2 электронов. К 18-электронным катионам относятся катионы цинка, кадмия, ртути, галлия, индия, таллия, германия, олова, мышьяка и сурьмы в высшей степени окисления. У катионов T1(I), Sn(II), Pb(II), As(III), Sb(III) и Bi(III) во внешней электронной оболочке находятся 18+2 электронов.
Для этой группы катионов характерны иные зависимости. В комплексах преобладает ковалентная связь, осуществляемая парой электронов, которые находятся в совместном владении катиона-комплексообразователя и лиганда. Во многих случаях изменение устойчивости комплексов катионов одной группы периодической системы хорошо коррелирует со способностью этих катионов к образованию ковалентной связи. По К.Б. Яцимирскому, эту способность можно количественно оценить величиной ковалентной характеристики, представляющей разность между энергией ионизации атома в вакууме и теплотой гидратации образующегося иона.
Наиболее отчетливо такая корреляция наблюдается для цинка, кадмия и ртути; величина ковалентной характеристики в этом ряду возрастает, в соответствии с чем увеличивается и устойчивость образуемых ими комплексов. Поэтому ионы ртути маскируются многими лигандами значительно сильнее, чем ионы кадмия, а последние лучше, чем ионы цинка. Такая зависимость наблюдается, например, при маскировании названных катионов посредством ЭДТА, нитрилотриуксусной кислоты и других родственных комплексонов, многих серосодержащих лигандов, например, с помощью унитиола, 2,3-димеркаптопропанола, цистеина и др. Тем не менее в рассматриваемой группе катионов наблюдаются нередко и другие зависимости, когда ионная связь преобладает и большее значение, чем ковалентная характеристика, приобретают размеры и заряды частиц.
Существенную роль в маскировании играет способность различных анионов образовывать комплексы неодинаковой устойчивости. Так, ионы фтора образуют с катионами первой группы (2- и 8-электронные катионы) более прочные комплексы, чем другие галогенид-ионы, что находит объяснение в жесткости электронных оболочек и в размерах галогенид-ионов. Сила взаимодействия катионов с малым анионом фтора велика по сравнению с анионами хлора, брома и иода. Поэтому ионы фтора являются хорошими лигандами для маскирования бериллия, алюминия, скандия, иттрия, лантана, титана, циркония, в то время как другие галогениды не проявляют заметного маскирующего действия по отношению к названным элементам. Однако в группе катионов с 18 электронами нередки обратные зависимости. Так, способность ионов иода к образованию ковалентной связи выражена значительно сильнее, чем у ионов брома, хлора и фтора, из-за больших размеров этого аниона и сравнительно большой тенденции к отщеплению электрона. Поэтому ртуть лучше всего маскируется иодид-ионами, действие хлорид- и бромид-ионов выражено значительно слабее, а фторид-ион не проявляет склонности к маскированию. Аналогичные явления характерны для катионов кадмия, висмута и некоторых других: из всех галогенидов наиболее сильное маскирующее действие проявляют ионы иода.
Для качественной оценки маскирующего действия лигандов можно также привлечь предложенный Пирсоном принцип жестких и мягких кислот и оснований (ЖМКО). Пирсон развил теорию Льюиса, в соответствии с которой кислотой считается частица (ион или молекула), являющаяся акцептором пары электронов, а основанием - частица (ион или молекула), выступающая донором пары электронов. Пирсон предложил различать в классах кислот и оснований жесткие и мягкие кислоты и основания. По Пирсону, жесткие кислоты характеризуются следующими признаками: они трудно поляризуются, имеют большой положительный заряд или высокое состояние окисления, малый радиус и образуют с основаниями соединения с преимущественно ионным типом связи. Жесткие кислоты, как правило, не имеют не поделенной пары валентных электронов. Мягкие кислоты характеризуются противоположными признаками: они легко поляризуются, имеют небольшой положительный зарядили низкую степень окисления, большие размеры. Преобладающий тип связи с основаниями - ковалентный. В своей электронной оболочке они содержат не поделенные пары электронов (р- или d-электроны).
Жесткие и мягкие основания содержат частицы, образующие комплексы с кислотами и выступающие нередко в качестве маскирующих лигандов. Существенно, что среди жестких оснований находятся лиганды с донорными атомами кислорода и азота, а в класс мягких оснований попадают лиганды с донорньгми атомами серы, фосфора и мышьяка. По Пирсону, для комплексов жестких кислот с основаниями, содержащими донорные атомы различных элементов, оказывается справедливым следующий ряд стабильности:
N>P>As>Sb
О > S > Se > Т1
F > CI > Вг > I.
Для комплексов же мягких кислот наблюдаются обратные соотношения:
N^P<As<Sb
<S<Se<Tl
F<CKBr<I.
Основания по степени возрастания или уменьшения мягкости или жесткости располагаются в ряды. Жесткость оснований, например, увеличивается в последовательности
ОН > = NH3 = H2N-CH2-CH2-NH2 > >HPOl">.F".
маскировка термодинамический кинетический ион
Мягкость оснований возрастает в ряду I" > Вг" > СГ" > S203"~ > S2 > >CN".
Из рассмотренных соотношений можно вывести простое правило, позволяющее качественно оценить стабильность кислотно-основных комплексов. Это правило, сформулированное Пирсоном в результате обобщения большого экспериментального материала, состоит в следующем. Жесткие кислоты предпочтительно связываются с жесткими основаниями, а мягкие кислоты предпочтительно связываются с мягкими основаниями.
Применимость принципа ЖМКО и сформулированного правила к оценке маскирующего действия лигандов создает возможность для рационального выбора и прогнозирования лигандов, обладающих наибольшим (или наименьшим) маскирующим эффектом. Так, фторид-ион, представляющий жесткое основание, образует стабильные комплексы с алюминием, бериллием, скандием, хромом(III), железом(Ш) и рядом других жестких кислот и, следовательно, проявляет к ним наибольшее маскирующее действие. Наоборот, фторид-ион не маскирует в заметной степени, например, катионы серебра, золота, палладия, кадмия, ртути и т.д., которые принадлежат к классу мягких кислот. Тиомочевина принадлежит к классу мягких оснований и в соответствии с этим выступает хорошо маскирующим лигандом по отношению к мягким кислотам - катионам серебра, золота, меди; несколько меньшая тенденция к образованию устойчивых комплексов должна проявляться по отношению к катионам промежуточной жесткости, например к катионам никеля, меди (И), свинца и т.д. Наконец, тиомочевина не маскирует жесткие кислоты - катионы титана, циркония, тория, алюминия, скандия, галлия и др.
Тиомочевина восстанавливает ионы меди (II) до меди(1). В соответствии с общим правилом мягкое основание - тиомочевина - связывается в прочный комплекс с мягкой кислотой - ионами Cu(I). ЭДТА содержит донорные атомы кислорода и азота, отличается вследствие этого жесткостью и не реагирует заметно с мягкой кислотой Cu(I). В то же время ЭДТА образует устойчивый комплекс с жесткой кислотой - ионами кальция. Последний не связывается в комплекс с мягким основанием - тиомочевиной. Вследствие рассмотренных соотношений представляется возможным маскировать медь тиомочевиной при комплексонометрическом титровании кальция.
Интересный пример представляет маскирование цинка цианидом калия при гравиметрическом определении алюминия посредством 8-оксихиноли-на. 8-Оксихинолин с донорными атомами азота и кислорода следует причислить к жестким основаниям; следовательно, он должен проявлять большую тенденцию к взаимодействию с жесткой кислотой - катионом алюминия, чем с менее жесткой кислотой - катионом цинка. С другой стороны, цианид-ион как мягкое основание образует достаточно устойчивый комплекс с катионом цинка - кислотой, занимающей промежуточное положение между жесткими и мягкими кислотами; но мягкое основание CN~ не образует комплекса с жесткой кислотой - А13+. Благодаря описанным свойствам компонентов реакций создается возможность гравиметрического определения алюминия 8-оксихинолином; цинк маскируется цианид-ионом и остается в растворе.
Принцип ЖМКО имеет ограниченное применение. Он не дает количественной интерпретации реакций маскирования и не учитывает многих других факторов, определяющих устойчивость комплексных соединений в растворах. Среди таких факторов важную роль играет способность лиганда образовывать замкнутые группировки атомов (хелатные соединения). Комплексы металлов с лигандами, образующими замкнутые пяти- или шести членные циклы, всегда устойчивее, чем комплексы с аналогичными монодентатными лигандами. Например, аммиакаты металлов менее устойчивы, чем комплексы этих же металлов с этилендиамином, несмотря на то, что координированные частицы содержат одинаковое число атомов азота, присоединенных к металлу. Имеет значение и количество циклов: возрастание числа циклов приводит к увеличению устойчивости. Так, три-этилентетрааминные комплексы меди с тремя замкнутыми циклами устойчивее диэтилентриаминного комплекса с двумя циклами, а последний комплекс устойчивее этилендиаминного комплекса, в котором есть только одна замкнутая группировка атомов.
Очень большое практическое значение имеет зависимость маскирующего действия различных лигандов от рН. Эта зависимость всегда проявляется у лигандов, имеющих солеобразующие группировки атомов, например -СООН, -ОН, =N-ОН и др. Интересно в этой связи сопоставить маскирование оксикислотами и комплексонами. И винная кислота, и ЭДТА реагируют с широким кругом ионов разнообразных металлов. ЭДТА, как правило, образует более устойчивые комплексы, чем винная кислота. Тем не менее маскирующее действие обоих лигандов проявляется по-разному при различных рН. В кислых и нейтральных растворах ЭДТА маскирует лучше, чем винная кислота, однако в щелочных растворах винная кислота является более сильным маскирующим агентом.
Таким образом, вполне надежные прогнозы маскирования возможны только с привлечением количественных методов расчета, основанных на использовании соответствующих констант.
Количественный расчет прогнозирования маскирующего действия представляет в общем случае трудную задачу. Для этого необходимо иметь информацию о константах устойчивости комплексов, образованных при взаимодействии маскирующего агента L с маскируемым ионом Y; маскирующего агента L с определяемым ионом X; реагента R с определяемым ионом X; реагента R с маскируемым ионом Y. Нередко следует также учитывать возможное взаимодействие L с R.
Существует, кроме того, много второстепенных процессов и факторов, усложняющих расчет, но которые тем не менее необходимо принимать во внимание. К их числу относятся следующие:
а) ступенчатая диссоциация или ступенчатое образование комплексов в растворе. Необходимо располагать сведениями о соответствующих константах устойчивости;
б) побочные гидролитические процессы, наиболее ярко выраженные при высоких значениях рН, когда речь идет о высоко зарядных ионах металлов типа ниобия, тантала и др.;
в) образование сложных по составу и строению полимерных частиц, особенно в растворах с большой концентрацией реагирующих или посторонних веществ;
г) образование разно метальных или разнолигандных комплексов. Информация о константах устойчивости таких комплексов до сих пор очень скудная, хотя роль этих соединений в аналитических определениях весьма значительна;
д) влияние ионной силы анализируемого раствора на величины констант устойчивости комплексов. Реальные аналитические определения почти всегда проводят в растворах, содержащих много посторонних сильных электролитов, создающих большую ионную силу.
Маскирование и условные константы устойчивости комплексов
Целью маскирования - понизить концентрацию мешающего иона Y до определенного предела, при котором реакция между Y и R уже не происходит. Важно знать оптимальную концентрацию маскирующего агента Cl, которую необходимо создать в растворе для достижения этой цели. Слишком высокая концентрация нередко затрудняет последующее определение X, так как может привести к различным побочным реакциям. Необходимо, следовательно, создать в растворе некоторую вполне определенную концентрацию CL, при которой условия определения X становятся наиболее благоприятными. Иными словами, концентрация CL должна быть такова, чтобы в растворе оставалась лишь некоторая небольшая доля несвязанного в комплекс Y, например, чтобы соотношение [YL] / [Y] было равно или меньше 100 или 1000. Расчет необходимой для этого концентрации может быть выполнен, если известна константа устойчивости комплекса YL.
Для оценки эффективности маскирования пользуются индексом маскирования.
Это логарифм отношения общей концентрации мешающего вещества к его концентрации, оставшейся не связанной. Индекс маскирования можно рассчитать, зная условные константы равновесия соответствующих маскирующих реакций.
Вещества, вводимые в анализируемую смесь с целью маскирования, называются маскирующими агентами или маскирователями. Они могут связывать мешающий ион <http://www.ximuk.ru/encyklopedia/1752.html> в прочные комплексные соединения, осаждать его или изменять степень его окисления <http://www.ximuk.ru/encyklopedia/2/3013.html>. Один и тот же маскирователь может действовать одновременно по разным механизмам (т. наз. многократное маскирование), напр. ионы <http://www.ximuk.ru/encyklopedia/1752.html> CN- восстанавливают Сu2+ до Сu+ и связывают последний в комплекс Cu(CN)43-. Иногда маскирователем служит один из участников аналитической реакции (автомаскирование), напр. осадок HgI2 не выпадает в присутствии избытка реагента <http://www.ximuk.ru/bse/2315.html> KI вследствие образования HgI42-. В ряде случаев используют сразу несколько маскирователей, например КI и NH3 при комплексонометрическом титровании <http://www.ximuk.ru/bse/2728.html> Сu2+ в присутствии Hg2+. Наибольшее значение имеют маскирователи, образующие комплексы: аминополикарбоновые кислоты (комплексоны <http://www.ximuk.ru/encyklopedia/2079.html>); оксикислоты <http://www.ximuk.ru/encyklopedia/2/3048.html>, чаще всего винная, лимонная, малоновая, салициловая и щавелевая; полифосфаты <http://www.ximuk.ru/bse/2164.html>, например пиро- и триполифосфаты Na; полиамины <http://www.ximuk.ru/encyklopedia/2/3450.html>, особенно три- и тетраэтилентриамин. Часто применяют галогенид-, цианид-, тиосульфат-ионы, NH3, глицерин <http://www.ximuk.ru/encyklopedia/1100.html>, тиомочевину <http://www.ximuk.ru/encyklopedia/2/4448.html>. К маскирователям относят также ПАВ, избирательно подавляющие полярографические волны мешающих веществ, и некоторые другие соединения, повышающие избирательность различных методов анализа. Все описанные выше случаи относятся к термодинамическому, или равновесному, маскированию. Значительно реже встречается кинетическое, или неравновесное, маскирование, примерами которого могут служить: подавление индуцированных реакций (в частности, взаимодействия Cl- с КMnО4 при пермангатометрического титровании <http://www.ximuk.ru/bse/2728.html> Fe2+ благодаря присутствию ионов <http://www.ximuk.ru/encyklopedia/1752.html> РО43 или SO42-; использование большой разницы скоростей образования комплексов с одним и тем же лигандом <http://www.ximuk.ru/biospravochnik/560.html> [напр., Сr(Н2О)63- реагирует с комплексонами <http://www.ximuk.ru/encyklopedia/2079.html> медленно, что делает возможным комплексонометрическое титрование <http://www.ximuk.ru/bse/2728.html> Fe3+ в присутствии Сr3+]; использование разницы скоростей экстракции <http://www.ximuk.ru/bse/3230.html> хелатов (например, дитизонатов Hg, Au и Сu при их разделении). Для оценки эффективности маскирования используют метод условных констант <http://www.ximuk.ru/bse/1354.html>.
Демаскирование - перевод замаскированного вещества в форму, способную вступать в реакции, обычно свойственные ему. Это достигается путем протонирования маскирующего соединения (если оно является слабым основанием), необратимым его разрушением или удалением (например, при нагревании), изменением степени окисления, связыванием в более прочное соединение. Например, демаскирование ионов металлов из комплексов с NH3, ОН-, CN-, F- можно осуществлять уменьшением рН. Пероксидные комплексы, например титана (IV), разлагаются кипячением в кислых растворах.
Основным способом маскировки мешающих ионов <http://www.xumuk.ru/encyklopedia/1752.html>, который применяется в аналитической химии <http://www.xumuk.ru/encyklopedia/271.html> и в химико-токсикологическом анализе, является комплексообразование <http://www.xumuk.ru/nekrasov/ix-02.html>. Пользуясь этим способом, для маскировки подбирают такой реактив, который с мешающими ионами <http://www.xumuk.ru/encyklopedia/1752.html> образует бесцветные прочные комплексные ионы <http://www.xumuk.ru/encyklopedia/1752.html>, не способные реагировать с реактивами на искомые ионы <http://www.xumuk.ru/encyklopedia/1752.html>. Использование комплексообразования <http://www.xumuk.ru/nekrasov/ix-02.html> для маскировки ионов <http://www.xumuk.ru/encyklopedia/1752.html> можно показать на нескольких примерах.
. Для обнаружения ионов <http://www.xumuk.ru/encyklopedia/1752.html> Со 2+ применяют роданид аммония <http://www.xumuk.ru/encyklopedia/256.html>. При этом образуется соединение (NH 4 ) 2 [Co(SCN) 4 ], имеющее синюю окраску. Обнаружению ионов <http://www.xumuk.ru/encyklopedia/1752.html> Со 2+ роданидом аммония <http://www.xumuk.ru/encyklopedia/256.html> мешают ионы <http://www.xumuk.ru/encyklopedia/1752.html> железа <http://www.xumuk.ru/encyklopedia/1527.html> (III), которые с этим реактивом дают кроваво-красную окраску. Для устранения мешающего влияния ионов <http://www.xumuk.ru/encyklopedia/1752.html> железа <http://www.xumuk.ru/encyklopedia/1527.html> (III) к смеси, содержащей ионы <http://www.xumuk.ru/encyklopedia/1752.html> кобальта <http://www.xumuk.ru/bse/1301.html> и железа <http://www.xumuk.ru/encyklopedia/1527.html>, прибавляют растворы <http://www.xumuk.ru/encyklopedia/2/3823.html> фторидов <http://www.xumuk.ru/encyklopedia/2/4936.html> или фосфатов <http://www.xumuk.ru/bse/2904.html>, которые переводят ионы <http://www.xumuk.ru/encyklopedia/1752.html> железа <http://www.xumuk.ru/encyklopedia/1527.html> (III) в бесцветный комплекс [FeF 6 ] 3-, не реагирующий с роданидом аммония <http://www.xumuk.ru/encyklopedia/256.html>. Таким образом, после маскировки ионов <http://www.xumuk.ru/encyklopedia/1752.html> железа <http://www.xumuk.ru/encyklopedia/1527.html> (III) фторидами <http://www.xumuk.ru/encyklopedia/2/4936.html> или фосфатами <http://www.xumuk.ru/bse/2904.html> можно легко обнаружить ионы <http://www.xumuk.ru/encyklopedia/1752.html> кобальта <http://www.xumuk.ru/bse/1301.html>, находящиеся в смеси с ионами <http://www.xumuk.ru/encyklopedia/1752.html> железа <http://www.xumuk.ru/encyklopedia/1527.html>, используя роданид аммония <http://www.xumuk.ru/encyklopedia/256.html>.
. Обнаружению ионов <http://www.xumuk.ru/encyklopedia/1752.html> кадмия <http://www.xumuk.ru/encyklopedia/1773.html> реакцией <http://www.xumuk.ru/bse/2325.html> с сероводородом <http://www.xumuk.ru/encyklopedia/2/4033.html> (образуется желтый осадок CdS) мешают ионы <http://www.xumuk.ru/encyklopedia/1752.html> меди <http://www.xumuk.ru/encyklopedia/2469.html>, которые с этим реактивом дают черный осадок CuS. Для маскировки ионов <http://www.xumuk.ru/encyklopedia/1752.html> меди <http://www.xumuk.ru/encyklopedia/2469.html> прибавляют растворы <http://www.xumuk.ru/encyklopedia/2/3823.html> цианидов <http://www.xumuk.ru/encyklopedia/2/5152.html>, образующие с указанными ионами <http://www.xumuk.ru/encyklopedia/1752.html> бесцветный комплекс [Cu(CN) 4 ] 3-, не реагирующий с сероводородом <http://www.xumuk.ru/encyklopedia/2/4033.html>.
Демаскировка ионов <http://www.xumuk.ru/encyklopedia/1752.html>. Демаскировкой называют процесс освобождения ранее замаскированных ионов <http://www.xumuk.ru/encyklopedia/1752.html> от маскирующих реактивов. В результате демаскировки ранее замаскированные ионы <http://www.xumuk.ru/encyklopedia/1752.html> восстанавливают способность вступать в реакции <http://www.xumuk.ru/bse/2325.html> с соответствующими реактивами. Демаскировка в основном осуществляется разложением комплексных ионов <http://www.xumuk.ru/encyklopedia/1752.html>, которые ранее образовались в процессе маскировки.
Процесс демаскировки можно показать на примере разложения следующих комплексных ионов <http://www.xumuk.ru/encyklopedia/1752.html>:
1. Ион меди Cu 2+ в водных растворах существует в форме аквокомплексов [Сu(H2O)m], при взаимодействии с аммиаком обретает растворимый комплекс [Cu(NH3)4] ярко сине-голубого цвета:
[Сu(H2O)m] + 4 NH3 = [Cu(NH3)4]2+ + n H2O
Ион Ва2+ можно осадить, прибавляя раствор, содержащий сульфат-ионы [SO42-], в форме малорастворимого белого осадка сульфата Ва:
Ва2+ + SO42-→ ВаSO4 ↓
Белый осадок карбоната Са2+ растворяется при действии кислот, при этом выделяется диоксид углерода:
СаСО3 + 2НСl → CаСl2 + СО2↑ + Н2О
. Если к раствору какой-либо соли аммония прибавить щелочь, то выделяется газообразный аммиак. Его можно легко определить по запаху или по посинению влажной красной лакмусовой бумаги:
Н4+ + ОН- = NН3. Н2О → NН3↑ + Н2О
Сульфиды при действии кислот выделяют газообразный сероводород:
2- + 2Н+ = Н2 S↑
. Ионы Nа+ в капле раствора при взаимодействии с гексагидроксостибат (V) - ионами
[Sв (ОН)6]- образуют белые кристаллы гексагидроксостибата (V) натрия Nа [Sв (ОН)6] характерной формы:
а+ + [Sв (ОН)6]- = Nа [Sв (ОН)6]
Форма кристалла хорошо видна при рассмотрении под микроскопом.
Эта реакция используется для открытия катиона Nа+
4. Окрашивание пламени газовой горелки соединениями металлов используются для открытия катионов металлов, дающих излучение в видимой области спектра. Окрашивание пламени в тот или иной цвет зависит от природы металла.
. Иногда проводят аналитические реакции, продукты которых обладают свойствами люминесценции в растворах. Так при взаимодействии катиона [Li+] c уранилацетатом цинка наблюдается зелёное свечение раствора, а с уранилацетатом натрия в уксусно-кислой среде даёт жёлто-зелёную люминесценцию.
|
из
5.00
|
Обсуждение в статье: Группы веществ, применяемые для маскировки |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

