 |
Главная |
Распространенность в природе
|
из
5.00
|
Введение
Один и самых распространенных химических элементов на Земле, марганец, имеет 25 номер в периодической системе Д.И. Менделеева лишь по счету, но никак не по своему значению. Невозможно представить современный мир без этого металла. Среди тяжёлых металлов (атомный вес больше 40) марганец занимает по распространенности в земной коре третье место вслед за железом и титаном. Оксиды марганца и его порошок находят широкое распространение как в лаборатории, так и в крупной промышленности.
Марганец - d-элемент VII группы периодической системы. Для марганца характерны разные степени окисления: от нулевой в Mn2 (CO) до +7 в KMnO4 и Mn2O10. В ряду напряжений марганец располагается до водорода. Он довольно активно взаимодействует с разбавленной HCl и H2SO4.
Для химии марганца очень характерны окислительно-восстановительные реакции. При этом кислая среда способствует образованию катионных комплексов Mn (II), а сильнощелочная среда - анионных комплексов Mn (VI). В нейтральной среде (а также слабокислой и слабощелочной) при окислительно-восстановительных процессах, образуются производные Mn (IV) (чаще всего MnO2).
Однако, несмотря на все его полезные и нужные свойства, соединения марганца могут оказывать на организм человека токсичное действие и даже привести к летальному исходу.
История открытия
Соединения марганца были известны человеку еще с древнейших времен. Они применялись при изготовлении стекла и посуды из глины. Одним из таких веществ был пиролюзит MnO2. Знаменитый металлург, итальянец по национальности, В. Бирингуччио в своих публикациях писал, что пиролюзит окрашивает стекло в фиолетовый цвет. Еще одним из интересных свойств данного минерала было то, что он устранял мутность стекол желтого и зеленого цветов.
Предположительно, что первым металлический марганец был получен ученым И. Каймом (Австрия). Это он сделал проведя спекание смеси, которая состояла из двух частей смеси угля с карбонатом калия и одной части пиролюзита. Полученные кристаллы были хрупкими и были голубовато-белого цвета. По всей видимости он был загрязнён различными примесями. Ученый проведя анализ кристаллов, только констатировал, что он не содержит железа. Свои исследования он так и не довел до конца.
Дальнейшая история марганца была связана с первооткрывателем никеля Т. Бергманом. Но он, хотя и пытался получить металл марганец, этого так и не сделал.
Третьим ученым, котрый предпринял попытку получить из пиролюзита марганец был К. Шееле. В 1774 году он выступил с докладом в Стокгольмской академии «Относительно марганца и его свойств», который подвел результаты его работы в течении трех лет. В ней он поведал о существовании двух металлов: бария и марганца.
Интересными датами в истории марганца можно считать 16 мая и 27 июня 1774 года. В мае Шееле отправил своему соотечественнику И. Гану очищенный пиролюзит, предложив ему провести разложение минерала. Ган поместил в угольный тигель смесь минерала и сильно раздробленным углем и прокаливал в течении часа. На дне тигля находился небольшой королек металла, масса которого была почти в три раза меньше, чем масса исходного минерала. Ган отправил его Шееле, который изучив его пришел к выводу, что был получен полуметалл, схожий с железом. Таким образом, можно сказать, что И. Гану принадлежит пальма первенства в открытии нового элемента. Недостатком было то, что полученный металл содержал больщие количества угля.
Независимо от них, не зная публикаций Шееле и Гана, в 1785 году марганец был получен немецким ученым-химиком И. Илземаном. Получил он его нагреванием смеси пиролюзита, плавикового шпата, извести и порошка из угля. Но образец металла получился даже более загрязненным чем у Шееле и Гана.
Первоначально вновь полученный металл назывался манганезиумом. Но когда был получен магний, которому дали название магнезиум, для избежания путаницы, название марганца переименовали на манганум.
Распространенность в природе
химический марганец элемент
Марганец - 14-й элемент по распространённости на Земле, а после железа - второй тяжёлый металл, содержащийся вземной коре (0,03 % от общего числа атомов земной коры). Весовое количество марганца увеличивается от кислых (600 г./т) к основным породам (2,2 кг/т). Сопутствует железу во многих его рудах, однако встречаются и самостоятельные месторождения марганца. В чиатурском месторождении (район Кутаиси) сосредоточено до 40 % марганцевых руд. Марганец, рассеянный в горных породах вымывается водой и уносится в Мировой океан. При этом его содержание в морской воде незначительно (10−7-10−6%), а в глубоких местах океана его концентрация возрастает до 0,3 % вследствие окисления растворённым в воде кислородом с образованием нерастворимого в воде оксида марганца, который в гидратированной форме (MnO2·xH2O) и опускается в нижние слои океана, формируя так называемые железо-марганцевые конкреции на дне, в которых количество марганца может достигать 45 % (также в них имеются примеси меди, никеля, кобальта). Такие конкреции могут стать в будущем источником марганца для промышленности.
Мировые запасы марганцевых руд представлены на 90 % оксидными (38 %) и оксидно-карбонатными (52 %) рудами.
В ЮАР около 95 % запасов сосредоточено в уникальной марганцево-железорудной зоне Куруман. Наиболее крупные месторождения Маматван (среднее содержание марганца 38 %), Весселс (47 %) Миддельплаатц (36 %)
В Китае, запасы марганца представлены мелкими, но многочисленными залежами оксидных руд. Среднее содержание в рудах 20-40 %. В стране постоянно проводятся поиски и разведка новых месторождений марганца с целью ослабить зависимость страны от импорта высококачественных руд.
В Казахстане более 90 % находится в Центрально-Казахстанском районе, в месторождениях Каражал и Ушкатын. Запасы около 85 млн. т (среднее содержание марганца 22 %).
Месторождения Украины находятся в Южно-Украинском марганцеворудном бассейне. Это месторождения Никопольской группы и Большетокмакское, содержащие 33 и 67 % подтвержденных запасов Украины. Украина обладает также и одним из самых мощных в Европе комплексов по переработке руды и производству марганцевых ферросплавов, включающим Никопольский, Запорожский и Стахановский заводы.
В Грузии основной сырьевой базой является Чиатурское месторождение. Оксидные руды составляют 28 % (среднее содержание марганца 26 %) подтвержденных запасов, карбонатные (среднее содержание марганца 18 %-72 %).
В России марганец является остродефицитным сырьем, имеющим стратегическое значение. Кроме указанных Усинского и Полуночного месторождений также известны Южно-Хинганские Малого Хингана в Еврейской области, Порожненское на Енисейском Кряже, Рогачево-Тайнинская площадь (260 млн т. карбонатных руд, с содержанием 8-15 %) и недоизученное Северо-Тайнинское рудное поле (5 млн т. окисных руд, с содержанием 16-24 %) на Новой Земле.
Минералы марганца:
· пиролюзит MnO2·xH2O, самый распространённый минерал (содержит 63,2 % марганца);
· манганит (бурая марганцевая руда) MnO(OH) (62,5 % марганца);
· браунит 3Mn2O3·MnSiO3 (69,5 % марганца);
· гаусманит (MnIIMn2III) O4;
· родохрозит (марганцевый шпат, малиновый шпат) MnCO3 (47,8 % марганца);
· псиломелан mMnO • MnO2 • nH2O (45-60 % марганца);
· пурпурит Mn3+[PO4], (36,65 % марганца).
Получение
Чистый марганец может быть получен электролизом растворов его солей. Однако, поскольку 90 % всей добычи марганца потребляется при изготовлении различных сплавов на основе железа, из руд обычно выплавляют прямо его высокопроцентный сплав с железом - ферромарганец.
Так же чистый марганец можно получить алюминотермическим методом, восстанавливая оксид Mn2O3, образующийся при прокаливании пиролюзита:


Физические свойства
Марганец - серебристо-белый твёрдый хрупкий металл. Известны четыре кристаллические модификации марганца, каждая из которых термодинамически устойчива в определённом интервале температур. Ниже 7070 С устойчив a-марганец, имеющий сложную структуру - в его элементарную ячейку входят 58 атомов. Сложность структуры марганца при температурах ниже 7070 С обусловливает его хрупкость.
Некоторые физические константы марганца приведены ниже:
Плотность, г/см37,44
Т. Пл., 0С 1245
Т. кип., 0С~2080, Дж/град·моль32,0
DHвозг.298, кДж/моль. 280Mn2+ + 2e = Mn, В - 1,78
Твёрдость
по шкале Бринелля: Мн/м²
по шкале Мооса: 4
Давление паров: 121 Па при 1244 °C
Молярный объём: 7,35 см³/моль.
В ряду напряжений марганец располагается до водорода. Он довольно активно взаимодействует с разбавленной HCl и H2SO4. В соответствии с устойчивыми степенями окисления взаимодействие марганца с разбавленными кислотами приводит к образованию катионного аквокомплекса [Mn (OH2) 6] 2+:
Mn + 2OH3 - + 4H2O = [Mn (OH2) 6] 2+ + H2
Вследствие довольно высокой активности, марганец легко окисляется, в особенности в порошкообразном состоянии, при нагревании кислородом, серой, галогенами. Компактный металл на воздухе устойчив, так как покрывается оксидной плёнкой (Mn2O3), которая, в свою очередь, препятствует дальнейшему окислению металла. Ещё более устойчивая плёнка образуется при действии на марганец холодной азотной кислоты.
Для Mn2+ менее характерно комплексообразование, чем для других d-элементов. Это связано с электронной конфигурацией d5 иона Mn2+. В высокоспиновом комплексе электроны заполняют по одному все d-орбитали:
В результате, на орбиталях содержатся d-электроны как с высокой, так и с низкой энергией; суммарный выигрыш энергии, обусловленный действием поля лигандов, равен нулю.
Химические свойства
Характерные степени окисления марганца: +2, +3, +4, +6, +7 (+1, +5 мало характерны).
При окислении на воздухе пассивируется. Порошкообразный марганец сгорает в кислороде (Mn + O2 → MnO2). Марганец при нагревании разлагает воду, вытесняя водород (Mn + 2H2O →(t) Mn(OH)2 + H2↑), образующийся гидроксид марганца замедляет реакцию.
Марганец поглощает водород, с повышением температуры его растворимость в марганце увеличивается. При температуре выше 1200 °C взаимодействует с азотом, образуя различные по составу нитриды.
Углерод реагирует с расплавленным марганцем, образуя карбиды Mn3C и другие. Образует также силициды, бориды, фосфиды.соляной и серной кислотами реагирует по уравнению:
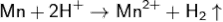
С концентрированной серной кислотой реакция идёт по уравнению:
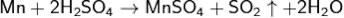
С разбавленой азотной кислотой реакция идёт по уравнению:
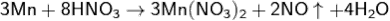
В щелочном растворе марганец устойчив.
Марганец образует следующие оксиды: MnO, Mn2O3, MnO2, MnO3 (не выделен в свободном состоянии) и марганцевый ангидрид Mn2O7.2O7 в обычных условиях жидкое маслянистое вещество тёмно-зелёного цвета, очень неустойчивое; в смеси с концентрированной серной кислотой воспламеняет органические вещества. При 90 °C Mn2O7 разлагается со взрывом. Наиболее устойчивы оксиды Mn2O3 и MnO2, а также комбинированный оксид Mn3O4 (2MnO·MnO2, или соль Mn2MnO4).
При сплавлении оксида марганца (IV) (пиролюзит) со щелочами в присутствии кислорода образуются манганаты:

Раствор манганата имеет тёмно-зелёный цвет. При подкислении протекает реакция:

Раствор окрашивается в малиновый цвет из-за появления аниона MnO4−, и из него выпадает коричневый осадок оксида-гидроксида марганца (IV).
Марганцевая кислота очень сильная, но неустойчивая, её невозможно сконцентрировать более, чем до 20 %. Сама кислота и её соли (перманганаты) - сильные окислители. Например, перманганат калия в зависимости от pH раствора окисляет различные вещества, восстанавливаясь до соединений марганца разной степени окисления. В кислой среде - до соединений марганца (II), в нейтральной - до соединений марганца (IV), в сильно щелочной - до соединений марганца (VI).
При прокаливании перманганаты разлагаются с выделением кислорода (один из лабораторных способов получения чистого кислорода). Реакция идёт по уравнению (на примере перманганата калия):

Под действием сильных окислителей ион Mn2+ переходит в ион MnO4−:
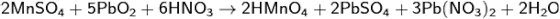
Эта реакция используется для качественного определения Mn2+ (см. в разделе «Определение методами химического анализа»).
При подщелачивании растворов солей Mn (II) из них выпадает осадок гидроксида марганца (II), быстро буреющий на воздухе в результате окисления.
Соли MnCl3, Mn2(SO4)3 неустойчивы. Гидроксиды Mn(OH)2 и Mn(OH)3 имеют основной характер, MnO(OH)2 - амфотерный. Хлорид марганца (IV) MnCl4 очень неустойчив, разлагается при нагревании, чем пользуются для получения хлора:
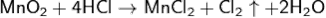
|
из
5.00
|
Обсуждение в статье: Распространенность в природе |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

