 |
Главная |
Механизм взаимодействия с клеткой. Патогенез ВИЧ-инфекции
|
из
5.00
|
Вирусы являются патогенами внутриклеточными, каждый вирус имеет тропность к определенному типу клеток. Его тропизм определяется наличием на клетке-мишени рецептора для данного вируса и возможностью генома вируса встроиться в геном клетки. Рецепторы могут быть на клетках различных типов. Рецепторную функцию выполняют лиганды: белки, липиды, углеводные компоненты белков и липидов. Они локализованы на плазматической мембране обеспечивают проникновение в клетку гормонов, питательных веществ, факторов роста и регуляции и т.п.
Рецепторы имеют общую структурную характеристику, то есть состоят из участка, расположенного вне клетки, локализованного внутримембранно участка, и участка, погруженного в цитоплазму.
Рецепторами для ВИЧ являются дифференцировочный антиген CD4 и не зависящие от наличия CD4 компоненты. CD4 - гликопротеид с молекулярной массой 55 000, по своему строению имеющий гомологии с определенными участками иммуноглобулинов. Фиксация вируса через gp120 ВИЧ-1 с мембранным рецептором CD4 клетки хозяина блокирует восприятие сигналов от анти-генпрезентирующих клеток. Дальнейшая репликация вируса приводит к гибели клеток, нарушению выполняемой ими функции и последующему развитию иммунодефицита.
В человеческом организме имеется ряд клеток, имеющих рецепторы для ВИЧ (CD4+ лимфоциты, CD8+ лимфоциты, дендритные клетки, моноциты, эозинофилы, мега-кариоциты, нейроны, микроглия, сперматозоиды), и в случае проникновения вируса наблюдается цитопатический эффект во многих из них.
Кроме основного рецептора - CD4, имеется еще ряд корецепторов, в частности, хемокиновые рецепторы, необходимые для проникновения ВИЧ в клетку. Хемокины - полипептиды, вызывающие движение клеток в определенной направленности. У человека выделено около 40 отдельных подобных белков, их подразделили на альфа- и бета-хемокины. В лаборатории Р. Галло в 1995 году были выделены хемокины из CD8-лимфоцитов и два белка из макрофагов. Они блокируют инфицирование CD+ мононуклеаров макрофаготропными, но не лимфотропными вариантами ВИЧ-1.
Таким образом, выделены белки - хемокины, блокирующие проникновение ВИЧ в макрофаги с антигеном CD4, и белки - корецепторы, способствующие инфицированию. При этом корецепторы - это рецепторы для хемокинов, но их использует ВИЧ в качестве рецептора, с помощью которого проникает внутрь клетки.
Проникнув в СD4+ клетки, ВИЧ сразу же начинает репликацию, при этом, чем активнее CD4+ клетки, тем выше процесс репродукции вируса. Все регуляторы, активирующие СD4+клетки, обеспечивают увеличение репликации вируса. К подобным регуляторам относятся фактор некроза опухолей (ФНО), фактор, стимулирующий колонии гранулоцитов/макрофагов, интер-лейкин-6 (ИЛ-6). К негативным регуляторам, тормозящим репликацию вируса, относятся интерферон (ИФ) и трансформирующий фактор роста. [6]
Вирус оказывает разнонаправленные действия не только на Т-лимфоциты, но и на клетки киллеры. Активность последних по мере прогрессирования заболевания неуклонно снижается, т.е. организм становится по мере прогрессирования заболевания всё менее устойчив к воспалительным процессам. Дефицит ИЛ-2 и γ-интерферона даже при нормальном количестве NK-клеток ведет к снижению функциональной активности их у больных ВИЧ-инфекцией (Ковальчук Л.В., Чередеев А.Н., 1991).
Выделено два типа CD4+клеток: Т-хелперы-1 (Th1) и Т-хелперы-2 (Th2). Тh1 продуцируют цитокины, стимулирующие клеточный иммунитет, а Тh2 - цитокины, усиливающие антителогенез. Соотношение Тh1 и Тh2 взвешенно и конкурентно; суперэкспрессия цитокинов одного типа клеток ведет к супрессии другого. У больных ВИЧ-инфекцией идет угнетение Тh1, чем обеспечиваются и вирусная патология, и онкогенез. [6]
Сродство вирусного мембранного гликопротеида gp120 (gp105 в случае ВИЧ-2) к клеточному рецептору CD4 определяет высокую степень избирательного поражения клеточных структур, поэтому в патологический процесс вовлекаются, в первую очередь, и в большей степени CD4+ лимфоциты, моноциты крови, макрофаги тканей, дендритные клетки крови, лимфатических узлов, селезенки, кожи, альвеолярных и интерстициальных макрофагов легких, микроглия и другие клетки нервной системы, имеющие CD4 - рецепторы. Так же поражаются В - и О-лимфоциты, ретикулярные клетки, эпителиальные клетки кишечника, клетки Лангерганса, причем последние инфицируются даже легче, чем CD4+ лимфоциты. Именно клеткам Лангерганса придается большое значение в распространении ВИЧ по организму, ибо в них вирус сохраняется длительное время, иногда годы.
Наличие CD4 рецептора на многих и не только иммунокомпетентных клетках, возможность поражать и клетки, не имеющие этого рецептора, определяют политропность ВИЧ и полиморфизм клинической картины. Степень поражения тех или иных, содержащих СD4 рецепторы, клеток зависит от плотности этих рецепторов на мембране клеток. Наиболее высока плотность на Т-хелперной субпопуляции лимфоцитов, что и определяет во мно-гом патогенез болезни. Но степень поражения клеток-мишеней вирусом зависит также и от возможности репликации вируса в том или ином виде клеток. Очевидно, осуществляется репликация в основном в лимфоцитах с CD4+ фенотипом и моноцитах/макрофагах.
Если на CD4+ лимфоциты вирус оказывает цитопатическое действие с лизисом клетки или слиянием в синцитий, то в моноцитах/макрофагах ВИЧ реплицируется с умеренной интенсивностью; вирионы оформляются в округлые частицы еще в цитоплазме клетки и по выходе из нее не оказывают цитонекротического действия. С гиперпродукцией ФНО-a, ИЛ-1b и ИЛ-6 связывают развитие при ВИЧ-инфекции лихорадки, анемии, диареи, кахексии, патологических изменений на коже и слизистых при саркоме Капоши, церебральных симптомов. ФНОa при этом оказывает прямое цитопатическое действие на инфицированные ВИЧ Т-хелперы. В то же время было установлено, что ВИЧ ингибирует продукцию ИЛ-2 и γ-ИФ, синтезируемым Т-хелперами первого типа, и не ингибирует функцию Т-хелперов второго типа. Следовательно, играя важную роль в регуляции синтеза цитокинов, ВИЧ за счет переключения иммунного ответа с Т-хелперов первого типа на Т-хелперы второго типа, стимулирует гуморальное звено иммунитета.
После инфицирования клетки вирусом происходит соединение вирусной оболочки с помощью белка gp41 с мембраной клетки. Помимо того, вирусный белок gp41 обеспечивает слияние мембран соседних клеток между собой с образованием одной многоядерной клетки - синцития. При этом слияние может быть как зараженных клеток между собой, так и зараженных с незараженными. Но синцитий в основном индуцируют вирусы, выделенные от больных с клиническими проявлениям ВИЧ-инфекции, и не образуют выделенные от инфицированных людей, не имеющих клинических проявлений. [6]
Когда геном вируса интегрируется в геном клетки начинается стадия латентной инфекции. В это время вирус находится в клетке в виде интегрированного в геном ДНК - провируса. Последние исследования показали, что сразу после проникновения вируса в клетку начинаются и трансляция, и транскрипция.
Состояние латентной инфекции без клинических признаков болезни может длиться от 2 до 11 лет. Активация длинных концевых повторов и экспрессия генов ВИЧ, кодирующих белки вируса, знаменуют собой манифестацию болезни. [6]
Выявлен ряд факторов, которые активируют экспрессию генов ВИЧ. К ним относятся факторы, активирующие Т-лимфоциты: специфические антигены (например, вирусы группы Herpes), неспецифические антигены (например, митогены типа фитогемаглютинина), цитокины (например, фактор некроза опухолей, некоторые интерлейкины, гамма-интерферон), бактериальные иммуномодуляторы (например, монофосфат липида из сальмонелл). К активаторам экспрессии ВИЧ можно отнести глюкокортикостероидные гормоны, такие как дексаметазон и гидрокортизон, ультрафиолетовое облучение, перекись водорода, свободные кислородные радикалы. Активирует также инфекционный процесс беременность; Более прогрессивно развивается ВИЧ у людей психически неуравновешенных, дезадаптированных, по сравнению с людьми, имеющими уравновешенную психику. [6]
Механизм репоикации вируса в клетке до сих пор до конца не известен. Известно только то, что в цитоплазме информация с вирусной РНК посредством обратной ревертазы переписывается на ДНК, первоначально образуется однонитевая структура; затем та же обратная транскриптаза обеспечивает образование второй нити, и линейная промежуточная форма ДНК-транскриптаза вируса - транспортируется в ядро, где с помощью фермента интегразы интегрирует в хромосому клетки, превращаясь в провирус.
Исключительно важный этап патогенеза болезни - сборка вирусных частиц и выход нового потомства вируса из инфицированной клетки. Сборка происходит на плазматической мембране лимфоцита, куда поступают все компоненты вирусной частицы, в том числе и белки-предшественники. Вирусы почкуются на поверхности клетки. Отличительной чертой ВИЧ является взрывной характер процессов активации транскрипции, синтеза белков-предшественников, сборки вирионов и их почкования: за 5 мин одна лимфоцитарная клетка может образовать до 5000 вирусных частиц.
Ключевой вопрос патогенеза ВИЧ-инфекции - механизм иммунного повреждения. В составе белков gp120, главного комплекса гистосовместимости (HLA) класса II и CD4-рецепторов имеются сходные участки, что определяет перекрестное реагирование образующихся к ВИЧ антител с этими структурами. На всех ядросодержащих клетках имеются антигены HLA I; вирус же нарушает синтез этих антигенов, участвующих в распознавании CD8+ лимфоцитами зараженных вирусом клеток, что тормозит процесс лизиса инфицированных клеток. [6]
Иммунопатогенетически ВИЧ-инфекция проявляется дефицитом Т - и В-звеньев иммунной системы, дефицитом комплемента, фагоцитов, снижением функции неспецифических факторов защиты. В результате идет формирование анергии с проявлениями аллергического, аутоаллергического и иммунокомплексного патологического процесса. Уже во II стадии ВИЧ-инфекция характеризуется снижением абсолютного числа лейкоцитов за счет CD3+, CD4+, p24+ и gp120+ лимфоцитов, повышением уровня естественных киллеров (NК-клетки), нарастанием реакции торможения миграции лимфоцитов с конкавалином А и фитогемагглютинином. Изменения гуморального звена иммунитета проявляются нарастанием IgG+ В-лимфоцитов и 4-5-кратным ростом уровня сывороточных IgE.
Для изменений В-звена иммунитета характерна активация В-лимфоцитов. Изменение их метаболизма сопровождается уменьшением времени полуобмена иммуноглобулиновых рецепторов с повышением в крови концентрации клеточных рецепторов (Р-белки). Суммарная концентрация сывороточных иммуноглобулинов растет, но выявляется диспропорция уровней подклассов иммуноглобулинов. Так, содержание IgG1 и IgG3 у больных увеличивается, а концентрация IgG2 и IgG4 существенно уменьшается. Очевидно, повышение уровня IgG2 связано с высокой восприимчивостью больных к стафилококкам, пневмококкам, палочке инфлюэнцы. Несмотря на гипергаммаглобулинемию, увеличение количества циркулирующих в крови В-лимфоцитов, их функциональная активность на митогены остаются относительно сниженными, что позволяет В-систему иммунитета у ВИЧ-больных расценивать как супрессированную. К тому же, количество В-клеток в периферической крови больных в стадии СПИДа может быть снижено в три и более раз.
Многочисленными исследованиями показано, что взаимодействие gp120 ВИЧ-1 с мембраной CD4+ лимфоцитов определяет не только отрицательные реакции инфицированных клеток, но и приводит к программированной клеточной гибели - апоптозу зрелых CD4+ лимфоцитов или CD34+ гемопоэтических клеток-предшественников даже при отсутствии их инфицирования вирусом.
Локализуясь в иммуноците, вирус проникает в органы и ткани, пребывая вне доступности для иммунной системы. Активация инфекционного процесса ведет к гуморальному иммунному ответу с образованием антител. Но в связи с наличием в составе вирусного белка gp120, HLA класса II и CD4-рецептора лимфоцита сходных участков образующиеся антитела перекрестно реагируют с ними, чем обусловливают нарушение кооперативных взаимодействий в функционировании иммунной системы. Все это определяет формирование аутоаллергических реакций. Именно поэтому в ходе развития инфекционного процесса формируется гиперчувствительность замедленного и немедленного типов, преимущественно к антигенам ВИЧ, в частности, gр41 и gp120. У половины больных развиваются манифестные формы аллергии, преимущественно в виде ринита, лекарственной аллергии, крапивницы, атопического дерматита, ангионевротического отека с повышением у них уровня специфических IgE к бытовым, эпидермальным, пыльцевым и пищевым аллергенам с положительной коррелятивной связью между общим уровнем IgE и содержанием СD8+ лимфоцитов (Ю.А. Митин, 1997).
Формирование иммунодефицита при ВИЧ-инфекции не ограничивается только поражением лимфоцитов с CD4-фенотипом. Нарушение синтеза белков HLA I ведет к ингибированию функции лимфоцитов с CD8-фенотипа, то есть Т-супрессоров. Белок вируса р15 оказывает супрессивное действие на продукцию Т-клетками ИЛ-2 и γ-интерферона. Известно, что для дифференцировки Т-эффекторов из Т-предшественников необходимы ИЛ-2, γ-интерферон и ИЛ-6. А с продукцией ИЛ-2 и других цитокинов тесно связана функция цитотоксических Т-лимфоцитов, ответственных за противовирусную и противоопухолевую защиту организма.
Наряду с поражением иммунной системы в патологический процесс вовлекается и кроветворная ткань. Для заболевания характерны лейкопения, анемия, тромбоцитопения. Угнетается функциональная активность гранулоцитов. У больных ВИЧ-инфекцией в костном мозге резко снижается содержание колониеобразующих единиц гранулоцитов, макрофагов, мегакариоцитов. На данный момент нет однозначного мнения о причинах ингибиции пролиферативной активности стволовых клеток, хотя и установлено, что различные изоляты ВИЧ, воздействуя на CD34+ клетки, угнетают их функциональную активность. Также установлено, что подавление кроветворения в результате действия ВИЧ связано с усилением продукции костномозговыми моноцитами/макрофагами фактора некроза опухолей.
Таким образом, поражение иммунной системы при ВИЧ-инфекции носит системный характер, проявляясь глубокой супрессией Т - и В-звеньев клеточного иммунитета. В ходе развития ВИЧ-инфекции происходят закономерные изменения гиперчувствительности немедленного и замедленного типа, гуморального иммунитета и факторов неспецифической защиты, функциональной активности лимфоцитов и моноцитов/макрофагов. Нарастает уровень сывороточных иммуноглобулинов, циркулирующих иммунных комплексов. Наряду с дефицитом CD4+ лимфоцитов в динамике болезни нарастает функциональная недостаточность СD8+ лимфоцитов, NK-клеток, нейтрофилов. Нарушение иммунного статуса клинически проявляется инфекционным, аллергическим, аутоиммунным и лимфопролиферативным синдромами иммунологической недостаточности, синдромом, свойственным болезни иммунных комплексов. Все это определяет в целом клинику ВИЧ-инфекции. [6]
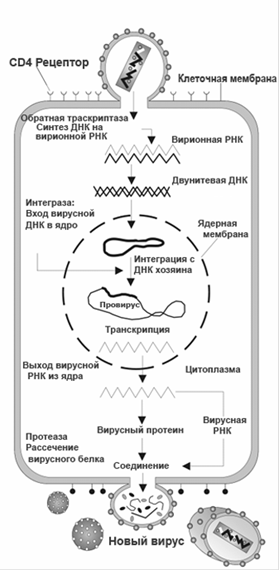
Схема проникновения ВИЧ в клетку и его размножения
|
из
5.00
|
Обсуждение в статье: Механизм взаимодействия с клеткой. Патогенез ВИЧ-инфекции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

