 |
Главная |
Титрование многоосновных кислот
|
из
5.00
|
Литературный обзор
Общая характеристика ступенчатого титрования
В количественном экспресс-анализе используются большей частью титриметрические и физико-химические методы.
Из титриметрических методов используется большинство известных способов титрования.
Несмотря на огромное разнообразие в химической структуре лекарственных веществ, много соединений имеют одинаковые функциональные группы, что дает возможность определять их одинаковыми химическими методами.
При количественном анализе необходимо выбрать наиболее точный и удобный метод, при этом руководствуются индивидуальными свойствами анализируемого вещества, а также видом лекарственной формы, рН среды, присутствие электролитов, а также веществ, которые вступают в аналогичные реакции.
Поэтому знание альтернативных вариантов определения различными титриметрическими методами. Особенностей взаимодействия индикаторов, титрованных растворов при анализе смесей приобретает особое значение.
Среди используемых приемов при количественном определении лекарственных средств титриметрическими методами особое место занимает ступенчатое титрование в общем и ступенчатое кислотно-основное титрование в частности.
В основе ступенчатого кислотно-основного титрования лежит метод последовательного определения лекарственных веществ данной смеси в одной отобранной пробе, используя различные индикаторы.
Так, данный метод можно использовать при определении смесей карбоновых кислот или их солей с барбитуратами, органическими основаниями, аминокислот в смеси с органическими кислотами, например, никотиновой и аскорбиновой.
При этом в зависимости от свойств компонентов смеси, используют следующие приемы:
если компоненты смеси значительно различаются по кислотно-основным свойствам, то используют два разных индикатора, титрование производится последовательно. При титровании смеси кислот или оснований с различными константами диссоциации вначале титруются более сильные кислоты (основания), затем - более слабые;
если один из компонентов смеси - кислота, а второй - основание или соль, то сначала оттитровывают кислоту, а на втором этапе - сумму присутствующей и образовавшейся соли или основания. Расчеты производят по разности затраченных растворов титрантов щелочи и кислоты соответственно;
если необходимо проанализировать смесь лекарственных веществ, одно из которых нерастворимо в воде, то используют смешанные растворители или их несмешивающуюся комбинацию. Так, подбором соответствующих растворителей и индикаторов можно определить два лекарственных вещества со сходными кислотно-основными свойствами;
неводное титрование включает два способа, один из которых позволяет определять каждый компонент в том растворителе, в котором данное вещество проявляет либо только кислотные, либо только основные свойства. Так определят системы кислота + соль, кислота + основание, основание + соль. Второй способ использует дифференцированное титровании в одном растворителе обоих ЛВ, имеющих разные константы ионизации. Так определяют системы основание + основание, соль + основание;
последовательное титрование одной навески ЛФ вначале в водной, а затем в неводной среде. Этот вариант используют в случае, если в смеси находятся слабые основания и более сильные основания, или слабые основания и слабокислые вещества, например, пуриновые алкалоиды и более основные алкалоиды или пуриновые алкалоиды и барбитураты.
Так, барбитураты можно определить алкалиметрическим титрованием после предварительного извлечения эфиром, а пуриновые алкалоиды определяют в неводной среде методом неводного титрования.
Теоретические основы ступенчатого титрования
Титрование многоосновных кислот
Возможности ступенчатого титрования можно показать на примере многоосновных кислот.
При титровании многоосновных кислот возможно появление двух или более скачков титрования.
Диссоциация двухосновной кислоты происходит по следующей схеме:
Н2А = НА- + Н+
НА- = А2- + Н+
Каждая стадия диссоциации соответственно характеризуется константой диссоциации:


Для определения с достаточной точностью необходимо, чтобы погрешность титрования была не более 1%. В данном примере это обозначает, что кислота по первой ступени должна прореагировать со щелочью не менее, чем на 99%, а по второй ступени - не более, чем на 1%.
Эти условия можно записать в виде следующих соотношений:


Перепишем выражения для констант диссоциации следующим образом:


При сочетании последних уравнений соответственно попарно получим следующие выражения:


Равновесные концентрации водорода в первом и втором выражении относятся к одному и тому же раствору, соответственно, они равны. Поделим первое уравнение на второе и упростим полученное выражение, получим:
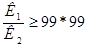 или
или
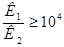
Таким образом, получили условие, которое указывает на возможность раздельного титрования многоосновной кислоты и, соответственно, двух веществ с различными константами диссоциации (например, смеси сильной и слабой кислот).
Условие следующее: титрование кислоты по первой ступени (или первой кислоты в смеси) с погрешностью не более 1% возможно, если вторая константа диссоциации на 4 порядка меньшей, чем первая.
Можно аналогичным образом показать, что при различии констант диссоциации на 6 и более порядков дает возможность оттитровать кислоты с погрешностью не более 0,1%.
В качестве примера рассчитаем кривую титрования трехосновной кислоты щелочью - 100 мл 0,1М раствора Н3РО4 0,1М раствором NaOH.
Для фосфорной кислоты имеются следующие справочные данные:
К1 = 7,6*10-3
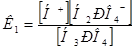
К2 = 6,3*10-8

К3 = 4,2*10-13

рН в первой точке титрования может быть рассчитано по уравнению:

 моль/л
моль/л

При прибавлении щелочи протекает реакция:
NaOH + H3PO4 = NaH2PO4 + H2O
После прибавления 9,0 мл гидроксида натрия равновесная концентрация H2PO4 - составит 0,009 + [H+], а концентрация H3PO4 соответственно будет 0,091 - [H+].
Подставим данные значения в выражение для константы диссоциации по первой ступени:

Откуда концентрация ионов водорода:
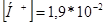
рН = 1,72
При прибавлении 50 мл щелочи получим: равновесная концентрация H2PO4 - составит 0,050 + [H+], а концентрация H3PO4 соответственно будет 0,050 - [H+].

Откуда концентрация ионов водорода:

рН = 2,22
Далее аналогичным образом можно получить, что при добавлении 90 мл гидроксида натрия концентрация ионов водорода составит:

рН = 3,17
При прибавлении 99 мл:

рН = 4,15
В точке эквивалентности рН рассчитывают с помощью такой формулы:


При прибавлении 101 мл равновесные концентрации ионов равновесная концентрация H2PO4 - составит 0,099 - [H+], а концентрация HPO42 - соответственно будет 0,001 + [H+].
Концентрацию ионов водорода рассчитаем по формуле:
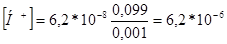 моль/л
моль/л
рН = 5,21
Аналогично рассчитываются другие точки до второй точки эквивадентности.
Для второй точки эквивалентности получим:
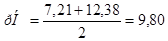
Аналогично рассчитывается кривая титрования до третьей точки эквивалентности.
Из полученных данных можно построить кривую титрования, изображенную на рис. 1.
На этой кривой имеется два скачка титрования: первый соответствует достижению первой точки эквивалентности, второй - второй точке эквивалентности.

Рис. 1. Кривая титрования 100 мл 0,1М раствора фосфорной кислоты 0,1М раствором гидроксида натрия
На кривой титрования показаны интервалы перехода метилоранжа и фенолфталеина (таблица 1). Эти индикаторы изменяют свой цвет в области первой и второй точки эквивалентности соответственно. Таким образом, фосфорная кислота титруется как одноосновная в присутствии метилоранжа и как двухосновная в присутствии фенолфталеина.
Данный пример иллюстрирует возможность титрования смеси кислот различной силы в присутствии двух индикаторов с соответствующими интервалами перехода окраски.
Таблица 1. Важнейшие кислотно-основные индикаторы
| Индикатор | Интервал перехода ΔрНInd | рТ | рКa(HInd) | Изменение окраски |
| Метиловый оранжевый | 3.1 - 4.4 | 4.0 | 3.5 | Красная - желтая |
| Бромкрезоловый зеленый | 3.8 - 5.4 | 4.5 | 4.9 | Желтая - синяя |
| Метиловый красный | 4.2 - 6.2 | 5.5 | 5.0 | Красная - желтая |
| Бромкрезоловый пурпурный | 5.2 - 6.8 | 6.0 | 6.4 | Желтая - фиолетовая |
| Бромтимоловый синий | 6.0 - 7.6 | 7.0 | 7.3 | Желтая - синяя |
| Феноловый красный | 6.8 - 8.4 | 7.5 | 8.0 | Желтая - красная |
| Тимоловый синий | 8.0 - 9.6 | 8.5 | 9.2 | То же |
| Фенолфталеин | 8.2 - 10.0 | 9.0 | 9.5 | Бесцветная - красная |
|
из
5.00
|
Обсуждение в статье: Титрование многоосновных кислот |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

