 |
Главная |
Пути регуляции активности ферментов
|
из
5.00
|
Регуляция скорости ферментативного катализа осуществляется 2-мя способами:
1) количеством фермента на уровне его биосинтеза;
2) активностью фермента.
Существуют следующие пути регуляции активности ферментов:
- ковалентная модификация;
- ассоциация и диссоциация;
- ингибирование;
- аллостерическая регуляция;
-влияние рН и температуры.
Ковалентная модификация заключается в присоединении к определенной части молекулы фермента или отщеплении от нее какой-либо группировки, что приводит к изменению активности фермента. Наиболее распространенными видами ковалентной модификации являются фосфорилирование и дефосфорилирование. При фосфорилировании происходит перенос фосфатной группы с АТФ на определенный остаток серина или треонина в молекуле фермента, этот процесс катализируют фосфопротеинкиназы. Дефосфорилирование сопровождается отщеплением фосфатной группы от молекулы фермента при участии фосфопротеинфосфатаз(рис. 8.1)
OH
АТФ АДФ I
Е - СН2ОН ¾¾¾¾¾¾® Е - СН2О - Р = О
Н3РО4 Н2О I
OH
дефосфорилированная форма фосфорилированная форма
фермента фермента
Рис. 8.1. Фосфорилирование и дефосфорилирование ферментов как разновидность ковалентной модификации
В ходе этих процессов изменяется активность ферментов.
Пример: гликогенфосфорилаза, участвующая в расщеплении гликогена, активна только в фосфорилированной форме, а гликогенсинтаза, принимающая участие в синтезе гликогена, активируется путем дефосфорилирования.
Разновидностью ковалентной модификации является регуляция активности ферментов на уровне профермента. Ряд ферментов синтезируется в неактивной форме, в виде профермента, переходящего в активное состояние в соответствующем месте и времени. Примером регуляции такого типа могут служить пищеварительные ферменты.
Например, трипсиноген, синтезирующийся в поджелудочной железе, активируется в тонком отделе кишечника в результате отщепления гексапептида с образованием активной формы - трипсина (рис.8.2.). Такой же тип регуляции используется в

|

|
Рис. 8.2. Активация профермента путем гидролиза специфических пептидных связей.
последовательности ферментативных реакций, ведущих к свертыванию крови.
Ассоциация и диссоциация характерны для олигомерных ферментов (имеющих 2 и более субъединиц). Ассоциация субъединиц чаще всего приводит к активации фермента, а диссоциация олигомерного фермента на отдельные субъединицы в большинстве случаев ведет к потере ферментом активности.
Часто ассоциация и диссоциация связаны с процессами фосфорилирования и дефосфорилирования. Пример: фосфорилирование каждой из субъединиц гликогенфосфорилазы способствует их ассоциации с образованием активного тетрамерного фермента.
Процесс торможения ферментативной активности называется ингибированием, а вещества его вызывающие - ингибиторами.
В зависимости от характера связывания фермента с ингибитором различают обратимое и необратимое ингибирование.
Обратимое ингибирование делится на конкурентное и неконкурентное.
При конкурентном ингибировании ингибитор, будучи близким по хими-
ческой структуре с субстратом, конкурирует с ним за связывание с активным центром фермента (рис8.3.).

|
Рис. 8.3. Схема конкурентного ингибирования. Конкурентный ингибитор препятствует связыванию фермента с субстратом
При более высокой концентрации ингибитора образуется фермент-ингибиторный комплекс (E+I = EI), не дающий продукта реакции. Тройной (фермент-ингибитор-субстрат) комплекс образоваться не может, так как и субстрат и ингибитор конкурируют между собой за один и тот же участок фермента, т.е. его активный центр. Конкурентное ингибирование преодолевается повышением концентрации субстрата. В этом случае происходит взаимодействие фермента и субстрата с образованием продукта реакции (E+S = ES® E + P).
Классическим примером конкурентного ингибирования является игибирование сукцинатдегидрогеназы малоновой кислотой:
COOH COOH
I I
CH2 сукцинатдегидрогеназа C- H
I ¾¾¾¾¾® II
CH2 H- C
I I
COOH COOH
янтарная кислота фумаровая кислота
(субстрат) (продукт реакции)
COOH
I
CH2 ¾/¾® реакция не идет
I
COOH
малоновая кислота (ингибитор)
 | 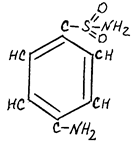 | ||
На принципе конкурентного ингибирования основано действие многих фармакологических препаратов. Например, для лечения некоторых инфекционных заболеваний применяют сульфаниламидные препараты, имеющие структурное сходство с пара-аминобензойной кислотой, которую бактерии используют для синтеза фолиевой кислоты.
пара-аминобензойная сульфаниламид
кислота
Применение сульфаниламидных препаратов ингибирует фермент, синтезирующий фолиевую кислоту (путем вытеснения пара-аминобензойной кислоты), что ведет к торможению роста бактерий.
При неконкурентном ингибировании действие ингибитора не преодолевается повышением концентрации субстрата.
Ингибитор не имеет структурного сходства с субстратом и связывается либо непосредственно с каталитическими группами активного центра фермента (рис.8.4) или с другим участком фермента, изменяя конформацию активного центра таким образом, что затрагивает структуру каталитического участка, мешая его взаимодействию с субстратом (рис. 8.5.).

|

|
Рис.8.4. Связывание ингибитора (Hg2+) с каталитическими группами(-SH) активного центра фермента.
Рис. 8.5. Неконкурентный ингибитор связывается с ферментом вне активного центра.
Поскольку неконкурентное ингибирование не влияет на связывание субстрата, то в отличие от конкурентного ингибирования наблюдается образование тройного комплекса (E+I+S = EIS), однако продукта реакции он не дает. Снять действие неконкурентного ингибитора можно веществами, связывающими этот ингибитор (рис.8.6.). Примерами неконкурентных ингибиторов являются ионы ртути, кадмия, мышьяка, свинца и их органические соединения. Эти ионы блокируют, например -SH группы каталитического участка фермента. Комплекс фермент-ингибитор может присоединять субстрат, но превращения последнего не происходит, так как каталитические группы активного центра фермента заблокированы.
Неконкурентные ингибиторы применяются в качестве фармакологических средств. Препараты, содержащие ртуть, мышьяк, висмут неконкурентно ингибируют ферменты в клетках организма или болезнетворных бактерий, чем и определяется их лечебный эффект.
При интоксикации вытеснение ингибитора, являющегося ядом, возможно с помощью реактиваторов или противоядий. К ним относятся тиолсодержащие соединения, лимонная кислота, этилендиаминтетрауксусная кислота.
При необратимом ингибировании ингибитор необратимо связывается с ферментом (E + I ® EI).
Примером такого ингибирования является связывание пенициллина с ферментом, участвующим в синтезе клеточных стенок бактерий.

|

|
Рис.8.6.Снятие действия неконкурентного ингибитора(Hg2+) с помощью реактиватора.
Важное место в регуляции обмена веществ принадлежит аллостерической регуляции, характерной для аллостерических (регуляторных) ферментов. Эти ферменты помимо активного имеют также аллостерический центр, с которым связываются положительные или отрицательные аллостерические эффекторы. В качестве эффекторов могут выступать гормоны, различные метаболиты, ионы металлов, коферменты, иногда молекулы субстратов. Аллостерические эффекторы влияют на конформацию активного центра фермента - положительные изменяют ее таким образом, что активный центр фермента взаимодействует с субстратом и осуществляет катализ химической реакции (рис.8.7.), а отрицательные действуют противоположным образом, переводя фермент в неактивное состояние (рис.8.8.).

|
Рис. 8.7 Перевод фермента в активное состояние при действии положительного аллостерического эффектора (активатора).

|
Рис.8.8. Перевод фермента в неактивное состояние при помощи отрицательного аллостерического эффектора (ингибитора).
Аллостерические ферменты занимают ключевое положение в метаболизме, поскольку тонко реагируют на изменения в обмене веществ и регулируют скорость прохождения веществ по целой системе ферментов.
E1 E2 E3 E4
A ¾x® B ¾® C¾® D¾® E
------------------------------/
Исходное вещество (А) превращается в конечное (Е) через промежуточные (В, С, D) под действием соответственно ферментов Е1, Е2, Е3, Е4.
Вещество Е - конечный метаболит этого пути, накапливаясь в больших количествах (превышающих потребности в нем клеток), ингибирует первый фермент Е1 этого пути, являющийся аллостерическим. Это аллостерическая регуляция по принципу обратной связи.
Для каждого фермента существует свой оптимум рН(табл. 1), при котором скорость катализируемой им реакции максимальна. Для большинства ферментов оптимум рН близок к нейтральному, хотя имеются ферменты, функционирующие при других значениях рН .
Таблица 1
Оптимальные значения рH для некоторых ферментов.
| Фермент | pH | Фермент | pH |
| Пепсин | 1,5-2,5 | Уреаза | 7,0-7,2 |
| Сахараза кишечника | 5,8-6,2 | Липаза панкреатина | 7,0-8,5 |
| Амилаза слюны | 6,8-7,0 | Трипсин | 7,5-8,5 |
| Каталаза | 6,8-7,0 | Аргиназа | 9,5-10,0 |
Изменение рН среды влияет на ионизацию кислотных (-СООН) и основных
( -NH2, -SH, N имидазольного кольца гистидина) групп аминокислотных остатков активного центра фермента, что сопровождается изменением активности фермента.
При оптимуме рН функциональные группы фермента и субстрата находятся в наиболее реакционно-способном состоянии.
Знание оптимумов рН ферментов имеет важное значение для практической медицины. Например, пепсин, расщепляющий пептидные связи в белках, функционирует в сильно кислой среде, поэтому для восстановления нарушенной активности эндогенного пепсина применят препарат пепсина с соляной кислотой, создающей нужный рН.
Оптимумом температур для большинства ферментов является температура тела 37 - 40оС (рис.8.9.) Более высокие температуры приводят к денатурации ферментов, так как по химической природе они являются белками .

|
Рис. 8.9. Зависимость скорости ферментативной реакции о температуры.
Влияние температуры на активность ферментов имеет существенное значение для понимания процессов жизнедеятельности. При понижении температуры скорость ферментативных реакций снижается, в результате снижается активность клеточных функций. Повышение температуры тела, например при инфекционных заболеваниях, ускоряет химические реакции в организме, что влечет за собой расточительное использование эндогенных субстратов в клетках больного организма.
Термозависимость ферментов широко используется в практике (искусственное охлаждение организма при проведении хирургических операций; хранение спермы, необходимой для искусственного осеменения с.-х. животных, осуществляется при температуре - 196оС; сохранность пищевых продуктов при низких температурах является результатом низкой активности ферментов микроорганизмов, способных вызвать порчу этих продуктов).
Основная литература
| Березов Т.Т., Коровкин Б.Ф. Биологическая химия. -М.: Медицина, 1990.- 528 с. |
| Биохимия животных./ Под редакцией проф. А.В. Чечеткина. - М.: Высш. Шк., 1982.- 511 с. |
| Кононский А.И. Биохимия животных. -Киев: Выща школа. Головное Издательство, 1980.-432 с. |
| Строев Е.А. Биологическая химия. -М.: Высш. шк., 1986.- 479 с. |
Дополнительная литература
| Горячковский А.М. Справочное пособие по клинической биохимии.-Одесса, 1994.- 416с. |
| Диксон М., Уэбб Э. Ферменты. в 3-х томах. - М.: Мир, 1982. |
| Коэн Ф. Регуляция ферментативной активности. - М.: Мир, 1986. |
| Ленинджер А. Биохимия. - М.: Мир,1976. -957 с. |
| Страйер Л. Биохимия. - М.: Мир, 1984. - т.1.- 232 с. |
|
из
5.00
|
Обсуждение в статье: Пути регуляции активности ферментов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

