 |
Главная |
Учебные таблицы: кривая титрования окислителя восстановителем
|
из
5.00
|
1. Приготовление раствора калия перманганата
Для выполнения работы готовят 500 мл раствора калия перманганата с примерной молярной концентрацией эквивалента 0,05 моль/л. Раствор готовят путем разбавления концентрированного раствора калия перманганата с молярной концентрацией эквивалента 0,5 моль/л.
Необходимый объем концентрированного раствора калия перманганата вычисляют из соотношения (2.7), которое в данном случае имеет вид:

где-  значения молярных концентраций эквивалента калия перманганата в растворе до и после разбавления;
значения молярных концентраций эквивалента калия перманганата в растворе до и после разбавления;

- объемы исходного и конечного растворов.
Рассчитанный объем концентрированного раствора калия перманганата отмеряют с помощью мерного цилиндра или градуированной пробирки и переносят в темную склянку вместимостью 0,5-1 л, добавляют до 500 мл дистиллированной воды, перемешивают и закрывают пробкой. На склянку наклеивают этикетку с указанием содержимого и номера студенческой группы.
2. Приготовление стандартного раствора натрия оксалата
Для выполнения работы готовят 250 мл стандартного раствора натрия оксалата с молярной концентрацией эквивалента 0,05 моль/л. Раствор натрия оксалата готовят по навеске с точно известной массой из кристаллического натрия оксалата. Необходимую теоретическую массу навески натрия оксалата рассчитывают по формуле (2.10), которая в данном случае имеет вид:

где 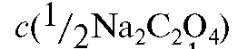 - молярная концентрация эквивалента натрия оксалата
- молярная концентрация эквивалента натрия оксалата
в растворе; -  молярная масса эквивалента натрия оксалата;
молярная масса эквивалента натрия оксалата;
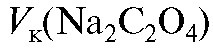 - объем приготавливаемого раствора натрия оксалата.
- объем приготавливаемого раствора натрия оксалата.
Молярную массу эквивалента натрия оксалата определяют, исходя из полу реакции:

и пользуясь Справочником, табл. 4.

Точную навеску натрия оксалата отбирают на аналитических весах по разности результатов двух взвешиваний и через сухую воронку осторожно переносят в мерную колбу на 250 мл. Содержимое колбы перемешивают вращательным движением до полного растворения соли и доливают водой до метки (последние капли добавляют с помощью пипетки). Колбу закрывают пробкой и тщательно перемешивают раствор, переворачивая ее вверх дном несколько раз.
Концентрацию и титр приготовленного раствора вычисляют по формулам (2.2) и (2.3), которые в данном случае имеют вид:

На этикетке колбы указывают ее содержимое и номер группы.
3. Стандартизация раствора калия перманганата понатрия оксалату
Сущность методики
В основе стандартизации титранта метода лежит прямое перманганатометрическое титрование. Стандартный раствор натрия оксалата титруют раствором калия перманганата в сернокислой среде при нагревании до появления устойчивой розовой окраски. При этом в процессе титрования в растворе протекает окислительно-восстановительная реакция:

Реакция является автокаталитической и ускоряется в присутствии катионов Mn2+. По результатам титрования рассчитывают концентрацию титранта.
3.1. Титрование натрия оксалата раствором калия перманганата
Методика
В колбу для титрования отбирают пипеткой 2 мл стандартного раствора натрия оксалата, добавляют 2 мл раствора серной кислоты с концентрацией 1 моль/л, полученную смесь нагревают до температуры 70- 80 °C (до появления паров) и титруют раствором калия перманганата. Первые капли титранта обесцвечиваются медленно, а последующие - мгновенно. Титрование проводят до появления устойчивого розового окрашивания раствора от одной капли титранта, не исчезающего в течение примерно одной минуты. Отсчет уровня титранта в бюретке проводят по верхнему мениску.
Титрование проводят не менее трех раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований 
заносят в табл. 2-9.
Таблица 2-9. Результаты стандартизации раствора калия перманганата

3.2. Расчет молярной концентрации эквивалента и титра раствора калия перманганата
По данным табл. 2-9 рассчитывают средний объем раствора калия перманганата,  который пошел на титрование стандартного раствора натрия оксалата, как среднее арифметическое объемов кислоты в трех параллельных титрованиях. Полученное значение заносят в табл. 2-9.
который пошел на титрование стандартного раствора натрия оксалата, как среднее арифметическое объемов кислоты в трех параллельных титрованиях. Полученное значение заносят в табл. 2-9.
По результатам титрования рассчитывают молярную концентрацию эквивалента и титр раствора калия перманганата.
Закон эквивалентов (2.11) для титрования натрия оксалата раствором калия перманганата имеет вид:

Отсюда концентрация приготовленного раствора калия перманганата равна (2.12):

Титр раствора калия перманганата рассчитывают по формуле (2.3), которая в данном случае имеет вид:

Молярную массу эквивалента калия перманганата определяют, исходя из полуреакции:

и пользуясь табл. 4 «Справочника». Полученные значения заносят в табл. 2-9.
4. Определение массы водорода пероксида в растворе
Сущность методики
В основе количественного определения водорода пероксида лежит прямое перманганатометрическое титрование. Аликвотную долю анализируемого раствора водорода пероксида титруют раствором калия перманганата в сернокислой среде до появления устойчивой розовой окраски. При этом в процессе титрования в растворе протекает окислительно-восстановительная реакция:

По результатам титрования рассчитывают массу водорода пероксида в анализируемом растворе.
4.1. Титрование водорода пероксида раствором калия перманганата
Методика
Полученную контрольную задачу в мерной колбе на 25 мл доводят водой до метки и тщательно перемешивают. В колбу для титрования отбирают пипеткой аликвотную долю анализируемого раствора объемом 2 мл, добавляют 2 мл раствора серной кислоты с концентрацией 1 моль/л и титруют раствором калия перманганата до появления устойчивой розовой окраски. Титрование проводят не менее 5 раз до получения воспроизводимых результатов. Полученные значения объемов титранта при проведении параллельных титрований  заносят в табл. 2-10.
заносят в табл. 2-10.
Таблица 2-10. Результаты титрования раствора водорода пероксида

4.2. Расчет массы водорода пероксида в анализируемом растворе
По данным табл. 2-10 рассчитывают массу водорода пероксида в анализируемом растворе для каждого титрования по формуле для прямого титрования определяемого вещества (2.15), которая в данном случае имеет вид:

Молярную массу эквивалента водорода пероксида определяют, исходя из полуреакции:

и пользуясь табл. 4 «Справочника».
По данным табл. 2-10 проводят статистическую обработку полученных результатов анализа по массе водорода пероксида.
|
из
5.00
|
Обсуждение в статье: Учебные таблицы: кривая титрования окислителя восстановителем |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

