 |
Главная |
Беседа по теме занятия
|
из
5.00
|
КОМИ ФИЛИАЛ
Государственного бюджетного образовательного учреждения высшего профессионального образования «КИРОВСКАЯ ГОСУДАРСТВЕННАЯ МЕДИЦИНСКАЯ АКАДЕМИЯ»
Министерства здравоохранения и социального развития Российской Федерации
Кафедра химии, физики, биологии
Методические указания для студентов1 курса
Специальности (направления подготовки) 060101 – Лечебное дело
к практическому (лабораторному) занятию
по дисциплине Химия
ТЕМА: Окислительно-восстановительные реакции. Методы окисления и восстановления в объемном анализе – перманганатометрия.
ЦЕЛЬ: Сформировать знания студентов об окислительно-восстановительных свойствах различных веществ, о влиянии условий на протекание окислительно-восстановительных реакций.
ЗАДАЧИ:
1. Научить использовать окислительно-восстановительные потенциалы для характеристики окислителей и восстановителей и для определения направления самопроизвольного протекания окислительно-восстановительных реакций.
2. Определить массовую долю перекиси водорода в исследуемом объекте.
СТУДЕНТ ДОЛЖЕН ЗНАТЬ:
1. до изучения темы: Степень окисления. Окислитель. Восстановитель. Типы ОВР.
2. после изучения темы: Электродные потенциалы. Уравнение Нернста-Петерса. Медико-биологическое значение ОВ-процессов.
СТУДЕНТ ДОЛЖЕН УМЕТЬ: Прогнозировать направление ОВР по величинам ОВ-потенциалов. Уравнивать ОВР методом электронно-ионного баланса. Определять методом перманганатометрии содержание восстановителей.
СОДЕРЖАНИЕ ЗАНЯТИЯ:
Вводный контроль.
Тестирование по теме занятия. Примерный перечень тестовых заданий:
1. Гальванический элемент Даниэля-Якоби:
1) медно-цинковый 2) железно-цинковый
3) оловянно-медный 4) железно-медный
2. Металл, окисляющийся ионами водорода (по ряду напряжения металлов)
1) Сu 2) Ag 3) Zn 4) Au
3. Металл, не способный окисляться ионами водорода (по ряду напряжения металлов)
1) Са 2)Fе 3)Cu 4) Al
4. К редокс-системам относится
l) Fe3+/Fe2+ 2) Сг3+/Сг(ОН)4- 3)Al3+/AlО2- 4) НСО3-/Н2СО3
5. К редокс-системам относится
1) HPO42- /H2PO4- 2)Cr2О72-/Cr3+ 3)Al3+/AlO2- 4) Zn2+/ZnO22-
6.Электрод сравнения, применяемый в медико-биологических исследованиях
1) водородный 2) мембранный 3) хлорсеребряный 4) платиновый
7.Электрод определения, применяемый в медико-биологических исследованиях
1) водородный 2) мембранный 3) стеклянный 4)каломельный
8. Электрод, применяемый для измерения рН растворов
1) водородный 2) мембранный 3) стеклянный 4)каломельный
9. Водородный электрод, в котором давление газообразного водорода равно 101,3 кПа, а активность ионов водорода в растворе равна 1 моль/л, является
1) нормальным 2) аномальным 3) стандартным 4) стабильным
10. Условием самопроизвольного и необратимого протекания реакции является
1) Е° < 0 2)Е° > 0 3) Е° = 0 4)Е°= 0±1
11. Носителями электрического тока в проводниках I рода являются
1) ионы 2) электроны 3) ионы и электроны 4) радикалы
12. Носителями электрического тока в проводниках II рода являются
1) ионы 2) электроны 3) ионы и электроны 4) радикалы
13. Электроны являются носителями электрического тока в: а) проводниках I рода; б) проводниках II рода; в) металлах; г) электролитах
1) б, г 2) а, б 3) б 4) а, в
14. Ионы являются носителями электрического тока в: а) проводниках I рода; б) проводниках II рода; в) металлах; г) электролитах
1) б, г 2) а, б 3) б 4) а, в
15. Проводниками II рода из перечисленных являются: а) Cu; б) CuSO4; в) KCl; г) HCl д) Zn
1) а, д 2) б, в, г 3) б, в 4) а, б, в, г
16. Проводниками I рода из перечисленных являются: а) Cu; б) CuSO4; в) KCl; г) HCl д) Zn
1) а, д 2) б, в, г 3) б, в 4) а, б, д
17. Термин «удельная электрическая проводимость» означает
1) проводимость вещества, находящегося между гранями куба с ребром, равным 1 м
2) проводимость слоя электролита толщиной 1 м, содержащего 1 моль вещества
3) величина, обратная сопротивлению
4) проводимость вещества при напряжении поля 1 В/м
18. Электрическая проводимость NaCl выше
1) в воде 2) в спирте 3) не зависит от растворителя 4) зависит от концентрации
19. Термин «молярная электрическая проводимость» означает
1) проводимость вещества, находящегося между гранями куба с ребром, равным 1 м
2) проводимость слоя электролита толщиной 1 м, содержащего 1 моль вещества
3) величина, обратная сопротивлению
4) величина, обратная удельному сопротивлению
20. Проводимость слоя электролита толщиной 1м, содержащего 1 моль вещества, называется
1) удельной 2) молярной 3) предельной 4) электролитической
21. Проводимость вещества, находящегося между гранями куба с ребром, равным 1 м, называется
1) удельной 2) молярной 3) предельной 4) электролитической
22. Переносчиками электронов в живых системах являются: а) хинон; б) никотиамидпроизводные; в) ионы металлов комплексов с биолигандами; г) молекулы воды
1) а, б, в 2) в 3) а, в, г 4) б, в
23. Электрическая проводимость ниже у
1) костной ткани 2) кожи 3) желудочного сока 4) крови
24. При сахарном диабете в моче может присутствовать глюкоза. При этом удельная электрическая проводимость
1) увеличивается 2) уменьшается
3) не изменяется 4) может и увеличиваться, и уменьшаться
25. Молярную электрическую проводимость водного раствора уксусной кислоты можно увеличить при: а) добавлении кислоты; б) добавлении воды; в) увеличении температуры; г) замене воды на спирт.
1) б, в 2) а, г 3) а, в, г 4) а, б, в
26. Гальваническим элементом называют устройство
1) состоящее из двух электродов и раствора электролита
2) для разложения вещества с помощью электричества
3) которое превращает химическую энергию в электрическую
4) для превращения электрической энергии в химическую
27. Если гальванический элемент работает самопроизвольно, то знак ЭДС элемента
1) положительный 2) отрицательный 3) зависит от концентрации вещества 4) постоянный
28. Катодом в гальваническом элементе называется электрод
1) на котором происходит процесс окисления
2) на котором происходит процесс восстановления
3) отрицательно заряженный
4) масса которого уменьшается
29. Анодом в гальваническом элементе называется электрод
1) на котором происходит процесс окисления
2) на котором происходит процесс восстановления
3) положительно заряженный
4) масса которого увеличивается
30. На отрицательном электроде гальванического элемента протекает реакция
1) окисления 2) восстановления 3) обмена электронами 4) обмена ионами металла
31. На положительном электроде гальванического элемента протекает реакция
1) окисления 2) восстановления 3) обмена электронами 4) обмена ионами металла
32. Зависимость потенциала электрода от активности ионов в растворе определяется уравнением
1) Фарадея 2) Вант-Гоффа 3) Гиббса 4) Нернста
33. Среди приведенных электродов выбрать электроды I рода: а) Cu|Cu2+; б) Ag|AgCl, KCl; в) Hg|HgCl, KCl; г) Zn|Zn2+; д) Pt|Fe3+, Fe2+
1) а, г 2) б, в 3) д 4) а, г, д
34. Среди приведенных электродов выбрать электроды II рода: а) Cu|Cu2+; б) Ag|AgCl, KCl; в) Hg|HgCl, KCl; г) Zn|Zn2+; д) Pt|Fe3+, Fe2+
1) а, г 2) б, в 3) д 4) а, г, д
35. Если два раствора KCl разной концентрации разделить катионселективной мембраной, то на границе раздела фаз возникает потенциал
1) диффузионный 2) окислительно-восстановительный
3) мембранный 4) электродный
36. Внутренняя поверхность клеточных мембран, проницаемых для ионов калия в состоянии физиологического покоя заряжена
1) положительно 2) отрицательно 3) не заряжена 4) имеет переменный знак
37. Какая среда в ротовой полости наиболее коррозионно опасна
1) нейтральная аэрированная слюна 2) кислая аэрированная слюна
3) кислая слюна, рН < 0 4) щелочная среда
38. Металл, разрушаемый на поверхности зубного протеза, изготовленного из сплава золота и меди
1) золото 2) медь 3) оба одновременно 4) никакой
39. Серебряно-палладиевые сплавы перспективны в ортопедической стоматологии, т.к.: а) стандартные потенциалы полуэлементов близки, а скорость коррозии незначистельна; б) можно применять при хронических заболеваниях рта и желудка; в) экономическая целесообразщность; г) не влияют на рН ротовой полости
1) а 2) б 3) а, б 4) а, б, в, г
40. Металл, разрушающийся при контакте со слюной стального протеза и серебряного припоя
1) железо 2) медь 3) оба одновременно 4) никакой
Беседа по теме занятия.
Степень окисления (С.Т.) - условный полный электрический заряд, который приписывается атомам в молекуле в предположении, что все связывающие их электронные пары сместятся к более электроотрицательному элементу. Т.е. предполагается, что связи между атомами будут ионными. Например, перекись водорода

Изменение С.Т. элементов в ходе реакции соответствует условному или реальному процессу отдачи или приема электронов в двух синхронно протекающих полуреакциях окисления и восстановления.
Окислитель (Ох) –исходное вещество, содержащее в своем составе атомы, которые понижают свою С.Т., что соответствует процессу присоединения электронов в полуреакции восстановления, где Ох переходит в свою полувосстановленную форму Red:
Ox + n e → Red Red – n e → Ox
Потенциальные окислители – вещества с атомами в высших положительных С.Т. Потенциальные восстановители – атомы с низшими отрицательными степенями окисления. Вещества, проявляющие ОВ-двойственность содержат атомы в промежуточных степенях окисления.

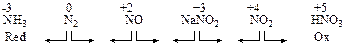
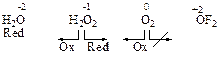
Для уравнивания ОВР применяют 2 метода: - электронный баланс (его можно использовать в любых случаях, а для реакций в газовых и твердых фазах он единственный); - электронно-ионный баланс – для реакций в растворах.
Электронный баланс:
а) получение белого фосфора из фосфорита:
2 Cа3(РО4)2 (тв) + 10 С (уголь) + 6 SiO2 (тв) → 6 CaSiO3 (тв) + 10 СО↑ + Р4↑
б) елочная хлопушка:

При составлении электронно-ионного баланса для реакций в растворе существуют следующие правила:
1. Обе полуреакции составляют на основе реально существующих в растворе частиц – ионов (для сильных электролитов), - молекул (для газов, твердых веществ, неэлектролитов и слабых электролитов).
2. Баланс по атомам Н и О устанавливают:
а) в кислой среде через Н+ и Н2О; б) в щелочной среде через ОН- и Н2О;
в) в нейтральной среде через Н2О, Н+, ОН-.
3. Полуреакции составлены правильно, если:
а) установлен баланс по атомам каждого вида слева и справа;
б) установлен баланс по зарядам слева и справа (определяют суммарный заряд справа, а затем слева подгоняют под него за счет ± ne.
4. Для полуреакций определяют числовые множители, чтобы число принятых и отданных электронов было равно. С их учетом производят суммирование полуреакций, приводят подобные слагаемые и получают уравнение в сокращенном ионном виде.
5. К правой и левой частям добавляют соответствующие противоионы и получают молекулярное уравнение.
Пример 1. Al + HNO3 (разб.) → Al(NO3)3 + NH4NO3 + H2O
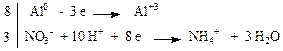
8 Al + 30 HNO3 (разб.) → 8 Al(NO3)3 + 3 NH4NO3 + 9 H2O
Пример 2. Al + КNO3 + КОН + Н2О → K[Al(OH)4] + NH3↑

8 Al + 3 КNO3 + 5 КОН + 18 Н2О → 8 K[Al(OH)4] + 3 NH3
Пример 3. C6H12O6 + K2Cr2O7 + H2SO4 → CO2 + Cr2(SO4)3 + K2SO4 + H2O
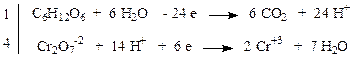
C6H12O6 + 4 K2Cr2O7 + 16 H2SO4 → 6 CO2 + 4 Cr2(SO4)3 + 4 K2SO4 + 22 H2O
Окислительные свойства перманганата калия зависят от характера среды:
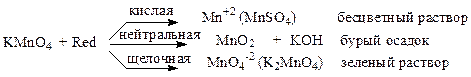
Перманганат-ион MnO4- в сильнокислых растворах окисляет многие вещества, восстанавливаясь при этом до иона двухвалентного марганца:
MnO-4 + 8Н+ + 5е = Mn2+ + 4Н2О
В связи с высоким значением восстановительного потенциала (φ0 = 1,551 В) его можно применять для титрования почти всех веществ, способных окисляться.
Основным условием титрования перманганатом является высокая кислотность среды; количество кислоты, необходимое для определения, нельзя рассчитывать по уравнению реакции. Необходимо, чтобы раствор был приблизительно 1н по кислоте, иначе в конце титрования, вследствие расхода кислоты на реакцию, концентрация водородных ионов сильно уменьшается, что приводит к понижению потенциала, а также к протеканию побочного процесса выделения осадка MnO2.
Чаще всего для подкисления применяют серную кислоту. Соляная кислота менее пригодна для этой цели, т.к. при этом возможно окисление ионов хлора перманганатом или различными промежуточными оксидами. Азотная кислота сама является сильным окислителем и может вызвать побочные процессы.
При титровании перманганатом обычно не применяют индикатор, т.к. собственная окраска раствора реагента достаточно интенсивна. Точку конца титрования устанавливают по появлению окраски при добавлении одной избыточной капли титранта к аликвоте исследуемого раствора.
Марганцевокислый калий не обладает абсолютно свойствами исходного вещества, соль часто содержит незначительные количества различных примесей, главной из которых является MnO2. Концентрация растворов KMnO4 некоторое время после приготовления медленно изменяется вследствие ряда причин. Вследствие этого раствор KMnO4 точно заданной концентрации не готовят непосредственно по точной навеске вещества; нормальную концентрацию устанавливают по какому-либо другому веществу – вторичному стандарту.
Хранят растворы KMnO4 в темной стеклянной посуде, защищенной от попадания пыли.
|
из
5.00
|
Обсуждение в статье: Беседа по теме занятия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

