 |
Главная |
Задачи для самостоятельного решения. 1.Точка движется по окружности радиусом /?
|
из
5.00
|
1.Точка движется по окружности радиусом /? = 4 м. Закон ее движения выражается уравнением s = A-\-Bt , где Л = 8м, В=— 2 м/с2. Определить момент времени t, когда нормальное ускорение а„ точки равно 9 м/с . Найти скорость v, тангенциальное ах и полное а ускорения точки в тот же момент времени г. [1,5 с; —6 м/с; —4 м/с2; 9,84 м/с2]
2. Две материальные точки движутся согласно уравнениям, xi = Ait + Bxt2 + dt3 и x2 = A2t + B2t2 + C2t3, где Л, = 4 м/с, В, = 8 м/с2, Ci = — 16 м/с3, Л2=2м/с, В2 = = _4 м/с2, С2=1 м/с3. В какой момент времени t ускорения этих точек будут одинаковы? Найти скорости v\ и г>2 точек в этот момент. [0,235 с; 5,1 м/с; 0,286 м/с]
3. Шар массой т,= 10кг сталкивается с шаром массой т2=4кг. Скорость первого шара t>i=4м/с, второго— v2= 12 м/с. Найти общую скорость и шаров после удара в двух случаях: 1) малый шар нагоняет большой шар, движущийся в том же направлении; 2) шары движутся навстречу друг другу. Удар считать прямым, центральным, неупругим. [6,28 м/с; —0,572 м/с]
4. В лодке массой М = 240кг стоит человек массой
т = 60кг. Лодка плывет со скоростью v = 2 м/с. Человек прыгает с лодки в горизонтальном направлении со скоростью и = 4м/с (относительно лодки). Найти скорость лодки после прыжка человека: 1) вперед по движению лодки; 2) в сторону, противоположную движению лодки. [ 1 м/с; 3 м/с]
5. Человек, стоящий в лодке, сделал шесть шагов вдоль нее и остановился. На сколько шагов передвинулась лодка, если масса лодки в два раза больше (меньше) массы человека? [2 шага; 4 шага]
6. Из пружинного пистолета выстрелили пулькой, масса которой т = 5г. Жесткость пружины k = = 1,25кН/м. Пружина была сжата на А/=8см. Определить скорость пульки при вылете ее из пистолета. [40 м/с]
7. Шар массой тп\ = 200 г, движущийся со скоростью v\ = 10 м/с, сталкивается с неподвижным шаром массой т2 = 800 г. Удар прямой, центральный, абсолютно упругий. Определить скорости шаров после столкновения. [—6 м/с; 4 м/с]
8. Шар, двигавшийся горизонтально, столкнулся с неподвижным шаром и передал ему 64% своей кинетической энергии. Шары абсолютно упругие, удар прямой, центральный. Во сколько раз масса второго шара больше массы первого? [В 4 раза]
9. Цилиндр, расположенный горизонтально, может вращаться вокруг оси, совпадающей с осью цилиндра. Масса цилиндра Ш\ = 12 кг. На цилиндр намотали шнур, к которому привязали гирю массой т2 = 1 кг. С каким ускорением будет опускаться гиря? Какова сила натяжения шнура во время движения гири? [1,4 м/с2; 8,4 Н]
10. Через блок, выполненный в виде колеса, перекинута нить, к концам которой привязаны грузы массами т, = 100 г и т2 = 300г. Массу колеса М=200 г считать равномерно распределенной по ободу, массой спиц пренебречь. Определить ускорение, с которым будут двигаться грузы, и силы натяжения нити по обе стороны блока. [3,27 м/с2; 1,31 Н; 1,96 Н]
11. Двум одинаковым маховикам, находящимся в покое, сообщили одинаковую угловую скорость а> = = 63 рад/с и предоставили их самим себе. Под действием сил трения маховик остановился через одну минуту, а второй сделал до полной остановки N = 360 оборотов. У какого маховика тормозящий момент был больше и во сколько раз? [У первого больше в 1,2 раза]
*—105

 верхности Земли и ее радиус R считать известными.
верхности Земли и ее радиус R считать известными.
169.Какова масса Земли, если известно, что Луна в течение года совершает 13 обращений вокруг Земли и расстояние от Земли до Луны равно 3,84 «108 м?
170. Во сколько раз средняя плотность земного вещества отличается от средней плотности лунного? Принять, что радиус i?3 Земли в 390 раз больше радиуса Rn Луны и вес тела на Луне в 6 раз меньше веса тела на Земле.
171. На стержне длиной /=30 см укреплены два одинаковых грузика: один — в середине стержня, другой — на одном из его концов. Стержень с грузами колеблется около горизонтальной оси, проходящей через свободный конец стержня. Определить приведенную длину L и период Т простых гармонических колебаний данного физического маятника. Массой стержня пренебречь.
172. Точка участвует одновременно в двух взаимно перпендикулярных колебаниях, уравнения которых х= =Aismoait и y=A2cos(u2t, где А\=8 см, Л2=4 см, (Di=o)2=2 с-1. Написать уравнение траектории и построить ее. Показать направление движения точки.
173.Точка совершает простые гармонические колебания, уравнение которых x=Asmoit, где Л=5 см, ш= = 2 с-1. В момент времени, когда точка обладала потенциальной энергией 11=0,1 мДж, на нее действовала возвращающая сила /г=5 мН. Найти этот момент времени t.
174.Определить частоту v простых гармонических колебаний диска радиусом /?=20 см около горизонтальной оси, проходящей через середину радиуса диска перпендикулярно его плоскости.
175.Определить период Т простых гармонических колебаний диска радиусом R = 40 см около горизонтальной оси, проходящей через образующую диска.
176.Определить период Т колебаний математического маятника, если его модуль максимального перемещения Дг=18 см и максимальная скорость итах=16 см/с.
177. Материальная точка совершает простые гармонические колебания так, что в начальный момент времени смещение х0—4 см, а скорость и0=Ю см/с. Определить амплитуду А и начальную фазу фо колебаний, если их период Т=2 с.
178. Складываются два колебания одинакового на
правления и одинакового периода: x\=At s'ma)\t и Х2=
= Л25тш2(/+ т), где Л1 = Л2 = 3 см, Ш) = и2 = лс-1,
т=0,5 с. Определить амплитуду А и начальную фазу ср0
результирующего колебания. Написать его уравнение. Построить векторую диаграмму для момента времени /=о.
179.На гладком горизонтальном столе лежит шар массой М=200 г, прикрепленный к горизонтально расположенной легкой пружине с жесткостью k = 500 Н/м. В шар попадает пуля массой т=10 г, летящая со скоростью и=300 м/с, и застревает в нем. Пренебрегая перемещением шара во время удара и сопротивлением воздуха, определить амплитуду А и период Т колебаний шара.
180.Шарик массой т=60 г колеблется с периодом 7=2 с. В начальный момент времени смещение шарика Хо=4,0 см и он обладает энергией £=0,02 Дж. Записать уравнение простого гармонического колебания шарика и закон изменения возвращающей силы с течением времени.
2. МОЛЕКУЛЯРНАЯ ФИЗИКА. ТЕРМОДИНАМИКА
Основные формулы
Количество вещества* тела (системы)
v = N/Na,
где N — число структурных элементов (молекул, атомов, ионов и т.п.), составляющих тело (систему); Na—постоянная Авогадро (NA= 6,02-1023 моль-1). Молярная масса вещества
М = m/v,
где щ — масса однородного тела (системы); v — количество вещества этого тела.
Относительная молекулярная масса вещества М,=2 п-Лг,и
где щ — число атомов i-го химического элемента, входящих в состав молекулы данного вещества; Ar,i — относительная атомная масса этого элемента. Относительные
* Количество вещества — число структурных элементов (молекул, атомов, ионов и т. п.), содержащихся в теле или системе. Количество вещества выражается в молях. Моль равен количеству вещества системы, содержащей столько же структурных элементов, сколько содержится атомов в углероде-12 массой 0,012 кг.
атомные массы приводятсяв таблице Д. И. Менделеева. См.также табл. 14Приложения.
Связь молярной массы М с относительной молекулярной массой вещества
М = Mrk,
где /е= 10~3 кг/моль.
Количество вещества смеси газов
v = vi + v2+ ... +vn= Ni/NA+N2/NA+ ... +N„/NA, или
m,\ , т2 , , m„
v Щ"т~ м2 "+" •■• "+" мп '
где vj, Ni, mi, Mi — соответственно количество вещества, число молекул, масса, молярная масса i-ro компонента смеси.
Уравнение Менделеева — Клапейрона (уравнение состояния идеального газа)
pV=-^RT=vRT,
где т — масса газа, М — молярная масса газа, R — молярная газовая постоянная, v — количество вещества, Т — термодинамическая температура.
Опытные газовые законы, являющиеся частными случаями уравнения Менделеева — Клапейрона для изопро-цессов:
а) закон Бойля — Мариотта (изотермический процесс:
r=const, m=const)
pV = const,
или для двух состояний газа
P\V\ = P2V2;
б) закон Гей-Люссака (изобарный процесс: р = const,
m=const)
— = const, или для двух состояний
Л = Л-г, п '
в) закон Шарля (изохорный процесс: /=const, /n=const)
-у= const,
или для двух состоянии
Pi Рг .
,. J, Г2 '
г) объединенный газовый закон (m=const) —г- = const, или ~— = —•=—,
I I 1 I 2
где piVi, T\—давление, объем и температура газа в начальном состоянии; р2, V2, T2 — те же величины в конечном состоянии.
Закон Дальтона, определяющий давление смеси газов,
p = pi-fp2+ ... +р„,
где pi — парциальные давления компонентов смеси; п — число компонентов смеси.
Парциальным давлением называется давление газа, которое производил бы этот газ, если бы только он один находился в сосуде, занятом смесью.
Молярная масса смеси газов
дд mi+m2+- +m„
Vl +V2+ ... +V„
m,
где m)—масса г-го компонента смеси; Vi = —------------------ коли
чество вещества i-ro компонента смеси; п — число ком
понентов смеси.
Массовая доля i-ro компонента смеси газа (в долях единицы или процентах)
mi
Wi = ,
m
где m — масса смеси. Концентрация молекул
| V М |
n = 4r= NfP
где N — число молекул, содержащихся в данной системе; р — плотность вещества; V — объем системы. Формула справедлива не только для газов, но и для любого агрегатного состояния вещества.
4/
 Основное уравнение кинетической теории газов
Основное уравнение кинетической теории газов
Р= 2/з« (&п) ,
где (е„> — средняя кинетическая энергия поступательного движения молекулы.
Средняя кинетическая энергия поступательного движения молекулы
<е„>=3/2*Г,
где k — постоянная Больцмана.
Средняя полная кинетическая энергия молекулы
<ei> = -i-fe7\
где i — число степеней свободы молекулы.
Зависимость давления газа от концентрации молекул и температуры
р = nkT. Скорости молекул:
Внутренняя энергия идеального газа Первое начало термодинамики
где Q — теплота, сообщенная системе (газу); Д£/ — изменение внутренней энергии системы; А — работа, совершенная системой против внешних сил. Работа расширения газа:
v2
А— \ р AV в общем случае;
А = p(V2 — Vi) при изобарном процессе; А = -Ј-RT\n-rf- при изотермическом процессе;
М\ V |
| V |
olt / орт
---- =~у —-------- средняя квадратичная;
---- = V —м------- средняя арифметическая;
| V |
2&7* / 2RT
---- = V ~м------- наиболее вероятная,
где т\ — масса одной молекулы. Относительная скорость молекулы
и = v/vB,
где v — скорость данной молекулы.
Удельные теплоемкости газа при постоянном объеме (су) и постоянном давлении (ср)
при адиабатном процессе, где y = cp/cv—показатель адиабаты.
Уравнения Пуассона, связывающие параметры идеального газа при адиабатном процессе:
| pV = const, | г2 г, | -( | V*) | -i |
| Р2 / УАТ р. Ч Vj • | г, | -(■ | ЈlVV" pJ | -D/Y |
| Термический КПД цикла | ||||
| и = | <?.- | Q2 |
| ( + 2 R |
| с„ = |
| М ' |
i R Cw==-2~W'
Связь между удельной с и молярной С теплоемкос-тями
с = С/М, С = сМ.
Уравнение Майера
Ср — Су
где Qi — теплота, полученная рабочим телом от тепло-отдатчика; Q2 — теплота, переданная рабочим телом теплоприемнику.
Термический КПД цикла Карно
| т,-Т2 |
Q,-Q2
Q.
гДе Г( и 7*2 — термодинамические температуры теплоот-Датчика и теплоприемника.
 | |||
 | |||
| _Л£_ |
| F I |
| <х = |
Коэффициент поверхностного натяжения
или а-
где F — сила поверхностного натяжения, действующая на контур /, ограничивающий поверхность жидкости;] А£ — изменение свободной энергии поверхностной плен ки жидкости, связанное/с изменением площади AS по] верхности этой пленки.
Формула Лапласа, выражающая давление р, созда ваемое сферической поверхностью жидкости:
2а
где R — радиус сферической поверхности.
Высота подъема жидкости в капиллярной трубке
| h = |
2а cos9
pgtf '
где 8 — краевой угол (0 = 0 при полном смачивании сте нок трубки жидкостью; 0 = я при полном несмачивании) R — радиус канала трубки; р — плотность жидкости g — ускорение свободного падения.
Высота подъема жидкости между двумя близкими и] параллельными друг другу плоскостями
, 2acos8
где d — расстояние между плоскостями.
Примеры решения задач
Пример 1.Определить для серной кислоты: 1) othochJтельную молекулярную массу Мг\ 2) молярную массу
Решение. 1. Относительная молекулярная MaccJ вещества равна сумме относительных атомных масс все| элементов, атомы которых входят в состав молекулы даь ного вещества, и определяется по формуле
Mr=2 titAr.i,
где tii — число атомов г-го элемента, входящих в моле кулу; Аг, i — относительная атомная масса i-ro элемента Химическая формула серной кислоты имеет ви| H2SO4. Так как в состав молекулы серной кислоты входя атомы трех элементов, то стоящая в правой части равен
ства (1) сумма будет состоять из трех слагаемых и эта формула примет вид
Mr = niAr, 1+ пчАг, 2 + п3Аг,з. (2)
Из формулы серной кислоты далее следует, что /ii=2 (два атома водорода), п2=1 (один атом серы) и м3=4 (четыре атома кислорода).
Значения относительных атомных масс водорода, серы и кислорода найдем в таблице Д. И. Менделеева или в табл. 14 Приложения:
Лг,,= 1, Лг,2 = 32, Лг,з=16.
Подставив значения /г, и Ar,i в формулу (2), найдем относительную молекулярную массу серной кислоты:
Л*, —2-1-f 1-32 + 4-16 = 98.
2. Зная относительную молекулярную массу Мг, найдем молярную массу серной кислоты по формуле
М = Mrk, (3)
где /г=10~~3 кг/моль.
Подставив в (3) значения величин, получим
М = 98-1СГ3 кг/моль.
Пример 2.Определить молярную массу М смеси кислорода массой гп\ = 25 г и азота массой тг=75 г.
Решение. Молярная масса смеси М есть отношение массы смеси т к количеству вещества смеси v:
M = m/v. (1)
Масса смеси равна сумме масс компонентов смеси:
т = гп\ -\-ni2-
Количество вещества смеси равно сумме количеств вещества компонентов:
v = v, + v2=~+1?r.Подставив в формулу (1) выражения т и v, получим
| (2) |
М =
mi/Mi + ГП2/М2
Применив метод, использованный в примере 1, найдем молярные массы кислорода Mi и азота Мг:
М, = 32-1(Г3 кг/моль; М2 = 28-1(Г3 кг/моль.
 Подставим значения величии в (2) и произведем вы-| числения:
Подставим значения величии в (2) и произведем вы-| числения:
Х/| 25-Ю-3+ 75-10"3___________ ,
М - 25-10-3/(32- 10-э) + 75-10-7(28- 1<Г3) КГ/М0ЛЬ ~
= 28,9.10_3 кг/моль.
Пример 3. Определить число N молекул, содержащих-! ся в объеме У=1 мм3 воды, и массу т\ молекулы воды.; Считая условно, что молекулы воды имеют вид шариков, i соприкасающихся друг с другом, найти диаметр d мо-1 лекул.
Решение. Число N молекул, содержащихся в не-] которой системе массой т, равно произведению постоянной Авогадро Na на количество вещества v:
N = vjVa.
Так как v=m/M, где М — молярная масса, то iV=]
= m ..А . Выразив в этой формуле массу как произведение]
плотности на объем V, получим
N = PVNa/M.
Произведем вычисления, учитывая, что М=18Х X Ю-3 кг/моль (см. табл. 14 Приложения):
N^ IJf'/o-T -6,02.1023 молекул = 3,34-1019 молекул.
Массу т\ одной молекулы можно найти по формуле!
тх = М/ЫА. (1)
Подставив в (1) значения М и Na, найдем массу моле-] кулы воды:
"I'=wKr=2-",ir26Kr-
Если молекулы воды плотно прилегают друг к другу,] то можно считать, что на каждую молекулу приходится] объем (кубическая ячейка) Vi=d3, где d — диаметр молекулы. Отсюда
d = W7 . (2)1
Объем Vi найдем, разделив молярный объем Vm на число молекул в моле, т. е. на Na:
y, = Vm/tfA. (J
Подставим выражение (3) в (2):
d = -^Vm/NA, где Vm=M/p. Тогда
d = \jM/(PNA). (4)
Проверим, дает ли правая часть выражения (4) единицу длины:
/ [^1 ) 1/з_/ _ 1 кг/моль 1 7з_ .
I [p][^a]J I 1кг/мМ моль"1) ~ М'
Произведем вычисления:
d=-yj з18'10"3,, м = 3,1Ы0-" м = 311 пм. V 103-6,02-1023
Пример 4. В баллоне объемом 10 л находится гелий под давлением pi= 1 МПа и при температуре 7^1 = 300 К. После того как из баллона было взято т=10г гелия, температура в баллоне понизилась до Г2=290К. Определить давление р2 гелия, оставшегося в баллоне.
Решение. Для решения задачи воспользуемся уравнением Менделеева—Клапейрона, применив его к конечному состоянию газа:
p2V=^-RT2, (1)
где т2 — масса гелия в баллоне в конечном состоянии; М — молярная масса гелия; R — молярная газовая постоянная.
Из уравнения (1) выразим искомое давление:
р2= m2RT2/{MV). (2)
Массу т2 гелия выразим через массу т,\, соответствующую начальному состоянию, и массу т гелия, взятого из баллона:
т2=т1—т. (3)
Массу т\ гелия найдем также из уравнения Менделеева — Клапейрона, применив его к начальному состоянию:
m\ = MP\V/(RT{). (4)
Подставив выражение массы т\ в (3), а затем выражение т2 в (2), найдем
| RT2 MV |
/ MpiV \
 или
или
| (5 |
| Р2 = - |
| ■Р\ |
т RT2 М V
Проверим, дает ли формула (5) единицу давления. Для этого в ее правую часть вместо символов величин подставим их единицы. В правой части формулы два слагаемых. Очевидно, что первое из них дает единицу давления, так как состоит из двух множителей, первый из которых (Т2/Т\) —безразмерный, а второй — давление. Проверим второе слагаемое:
| ■X |
[ш] [R] [Т] _ 1 кг1 Дж/(моль-К)-1К _ 1 кг-1 м
1 кг
[М] [V] 1 кг/моль 1 м3
| 1 Н-м |
| 1 Н |
| = 1 Па. |
х_ 1Дж-1К 1 Дж
| 1м2 |
| 1 MJ |
■ 1 моль-1 К
Паскаль является единицей давления. Произведе вычисления по формуле (5), учитывая, что М-= 4-10~3 кг/моль (см. табл. 14 Приложения):
| ю- |
| 290 300 |
| :,31 |
| ч |
| •106 |
| Ра |
| .. 290 ю : 0,364 МПа |
| 4-10" |
>) Па = 3,64-105 Па =
Пример 5.Баллон содержит mi = 80 г кислорода и| /П2 = 320 г аргона. Давление смеси р= 1 МПа, температура 7 = 300 К- Принимая данные газы за идеальные,! определить объем V баллона.
Решение. По закону Дальтона, давление смеси! равно сумме парциальных давлений газов, входящих в| состав смеси. По уравнению Менделеева — Клапейрона,! парциальные давления р\ кислорода и р2 аргона выра-1 жаются формулами
p, = m,/?7y(M,V), р2 = т2/?Г/(М2У).
Следовательно, по закону Дальтона, давление смеси! газов
| RT V ' |
. /mi . тЛ
P = Pi+P2, ИЛИ р={—- + —)
откуда объем баллона
у / т\ . m2\ RT
(01
Произведем вычисления, учитывая, что Mi = 32X X 10~3 кг/моль, М2 = 40-10~3 кг/моль (см. табл. 14 Приложения) :
у==(_2а_+-^) «К»-зоо м3 = 0,0262 м3 = 26,2 л.
V 32-10-J т 40-10"3/ 106
Пример 6.Найти среднюю кинетическую энергию <евр) вращательного движения одной молекулы кислорода при температуре Т = 350 К, а также кинетическую энергию Ек вращательного движения всех молекул кислорода массой т = 4 г.
Решение. На каждую степень свободы молекулы газа приходится одинаковая средняя энергия (ei) =
= у &7\ где k — постоянная Больцмана; Т — термодинамическая температура газа. Так как вращательному движению двухатомной молекулы (молекула кислорода — двухатомная) соответствуют две степени свободы, то средняя энергия вращательного движения молекулы кислорода
<е.р>=2--1-М\ (1)
Кинетическая энергия вращательного движения всех молекул газа
£к=<евр>ЛГ. (2)
Число всех молекул газа
N=NAv, (3)
где Na — постоянная Авогадро; v — количество вещества.
Если учесть, что количество вещества v=m/M, где m — масса газа; М — молярная масса газа, то формула (3) примет вид
Подставив выражение N в формулу (2), получаем
£К=Л/Ат<евр>/М. (4)
Произведем вычисления, учитывая, что для кислорода М = 32- Ю-3 кг/моль (см. табл. 14 Приложения):
<евр> = /г7,= 1,38-10-23-350Дж = 4,83-10-21 Дж; £к=6,02-1023- 4"'°133-4>83-10~2' Дж = 364Дж.
Пример 7.Вычислить удельные теплоемкости при постоянном объеме cv и при постоянном давлении ср неона и водорода, принимая эти газы за идеальные.
Решение. Удельные теплоемкости идеальных газов выражаются формулами
Ср~ 2 М' (2)
где г — число степеней свободы молекулы газа; М — молярная масса. Для неона (одноатомный газ) /=3 и М= 20-Ю-3 кг/моль (см. табл. 14 Приложения). Произведем вычисления:
3 8,31
| Cv = |
- )0^Дж/(кг.К) = 6,24.102 Дж/(кг.К);
с"= 3t2 208'ш-з Дж/(кг-К) = 1,04-103 Дж/(кг-К).
Для водорода (двухатомный газ) 1=5 и М = = 2-10~3 кг/моль. Тогда
C*=TTW? Дж/(кг.К) = 1,04.104 Дж/(кг.К); Ср= 5t2 28io-3 Дж/(кг-К) = 1,46.104 Дж/(кг.К).
Пример 8.Вычислить удельные теплоемкости cv и ср смеси неона и водорода, если массовые доли неона и водорода составляют да, = 80% и uz>2 = 20%. Значения удельных теплоемкостеи газов взять из предыдущего примера.
Решение. Удельную теплоемкость cv смеси при постоянном объеме найдем следующим образом. Теплоту, необходимую для нагревания смеси на AT, выразим двумя способами:
Q = Cv(mi + m2)A7', (1)
Q = (cy,imi-r-cy,2/n2)A7\ (2)
где Cv,\ — удельная теплоемкость неона; Cv,2 — удельная теплоемкость водорода.
Приравняв правые части (1) и (2) и разделив обе
части полученного равенства на AT, получим с\{т\-\-Jt-m2) = cv,itni + cv,2tn2. Отсюда
П%2
Cv=Cv,\--------- г------ И С
| V.2- |
mi + m2 ' mi -\- m.2 '
или
Cv=CV,\W\ +Су,2Ш2,
/П| тг
где W\=--------- :----- И 102 =------ г---- .
Рассуждая так же, получим формулу для вычисления удельной теплоемкости смеси при постоянном давлении:
Cp=Cp,iW\ + CP,2W2-
Произведем вычисления: cv= (6,24• 102• 0,8 + 1,04• 104• 0,2) Дж/ (кг• К) =
= 2,58-103 Дж/(кг-К) =2,58 кДж/(кг-К); ср = (1,04-103-0,8+1,46-104-0,2) Дж/(кг-К) =
= 3,75-103 Дж/(кг-К)=3,75 кДж/(кг-К).
Пример 9.Кислород массой т = 2кг занимает объем V, = 1 м3 и находится под давлением р1 = 0,2МПа. Газ был нагрет сначала при постоянном давлении до объема у2 = 3м, а затем при постоянном объеме до давления р3 = 0,5МПа. Найти изменение AU внутренней энергии газа, совершенную им работу А и теплоту Q, переданную газу. Построить график процесса.
Решение. Изменение внутренней энергии газа
AU = cvmAT=±-^rmAT; (1)
где i — число степеней свободы молекул газа (для двухатомных молекул кислорода г"=5); АТ=Тз—Т\ — разность температур газа в конечном (третьем) и начальном состояниях.
Начальную и конечную температуру газа найдем из
уравнения Менделеева — Клапейрона pV= , откуда
T=pVM/(mR).
Работа расширения газа при постоянном давлении выражается формулой
л— т' 1 MRIS.T '
 Работа газа, нагреваемого при постоянном объеме] равна нулю:
Работа газа, нагреваемого при постоянном объеме] равна нулю:
А2 = 0.
Следовательно, полная работа, совершаемая газом!
А = А1+А2 = А1.
Согласно первому началу термодинамики, теплота Q1 переданная газу, равна сумме изменения внутренней! энергии AU и работы А:
Q = AU + A.
| 2-105-1-32-10-г 2-8,31 2-105-3-32-1СГ3 |
Произведем вычисления, учтя, что для кислорода! М = 32-10~3 кг/моль (см. табл. 14 Приложения):
| Т2=- |
| 2-8,31 5- 105-3-32-1(Г3 |
К = 385 К; К = 1155 К;
| 7-3 = |
К = 2887 К;
| 8,31-2.(1155 — 385) |
2-8,31
Дж = 0,400-106 Дж = 0,4 МДж;
32-10"'
Л = Л, = 0,4 МДж; 5 8,31-2(2887-385)
| AU- |
Дж = 3,24-10ь Дж=3,24 МДж;
32-10-
Q = (3,24+ 0,4) МДж = 3,64 МДж.
соотношением
| или -=-=- |
| 11 |
Г2=/ УЛ Г, \ У2)
где V — отношение теплоемкостей газа при постоянном давлении и постоянном объеме; ti\ = V2/V\.
Отсюда получаем следующее выражение для конечной температуры:
7-2= Г,/лП-.
Работа А\ газа при адиабатном расширении может быть определена по формуле
л1=1,-^Су<г,--гг)-~4-«(г,-Ы
где Cv — молярная теплоемкость газа при постоянном объеме. Работа А2 газа при изотермическом процессе может быть выражена в виде
где п2 = V2/Vz.
| г К. |
Произведем вычисления, учитывая, что для водорода как двухатомного газа 7=1.4, г = 5 и М = 2-10_3 кг/моль:
| К = |
Т2 =
Так как 50,4=1,91 (находится логарифмированием),
| зоо |
то
| 1,91 |
К=157К;
|
| *-V |
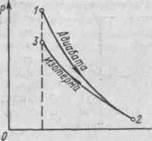
График процесса приведен на рис. 7.
Пример 10.В цилиндре под поршнем находится водород массой т = 0,02 кг при температуре 7*1 = 300
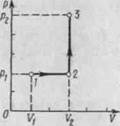
|
Водород сначала расширился адиа-батно, увеличив свой объем в щ = 5 раз, а затем был сжат изотермически, причем объем газа уменьшился в п-i = 5 раз. Найти температуру в конце адиабатного расшире-1 ния и работу, совершаемую газом] при этих процессах. Изобразить] процесс графически.
Решение. Температуры и объ
емы газа, совершающего адиабат-]
Рис. 7 ный процесс, связаны между собой]
| 2-Ю"3-2 0,02 |
, = °f2;5;:f'f (300-157) Дж = 29,8 кДж;
| —21 кДж. |
| А2 = - |
т-8,ЗЫ57 1п+Дж =
6 о
2-10
Знак минус показывает, что при сжатии работа газа совершается над газом внешними силами.
График процесса приведен на рис. 8.
| Рис. 8 |
Пример11. Тепловая машина работает по обратимому циклу Карно. Температура теплоотдатчика Г, = = 500 К. Определить тер-
 |
| Г |
мический КПД г\ цикла и температуру Г2 теплоприем ника тепловой машины, если за счет каждого кило джоуля теплоты, полученной от теплоотдатчика, машин! совершает работу А — 350 Дж.
Решение. Термический КПД тепловой машины показывает, какая доля теплоты, полученной от тепло! отдатчика, превращается в механическую работу. Терми! ческий КПД выражается формулой
r\ = A/Qu.
где Qi — теплота, полученная от теплоотдатчика; А работа, совершенная рабочим телом тепловой машины
Зная КПД цикла, можно по формуле t) = (jTi — Г2)/Г| определить температуру охладителя Т2:
Г2=Г,(1—т,).
Произведем вычисления:
т| = 350/1000 =0,35; Т2 = 500( 1 - 0,35) К = 325 К
Пример 12. Найти добавочное давление внутри мыль ного пузыря диаметром й=10см. Какую работу нужнс совершить, чтобы выдуть этот пузырь?
Решение. Пленка мыльного пузыря имеет два сферические поверхности: внешнюю и внутреннюю. Обе поверхности оказывают давление на воздух, заключенный внутри пузыря. Так как толщина пленки чрезвычайно мала, то диаметры обеих поверхностей практически одинаковы. Поэтому добавочное давление
Р = 2 —,
где г — радиус пузыря. Так как r — d/2, то
p = 8a/d.
Работа, которую нужно совершить, чтобы, растягивая пленку, увеличить ее поверхность на AS, выражается формулой
A = aAS, или A = o(S — So).
В данном случае S — общая площадь двух сферически! поверхностей пленки мыльного пузыря; So — общай площадь двух поверхностей плоской пленки, затягивав шей отверстие трубки до выдувания пузыря. Пренебрег гая So, получаем
A = aS = 2nd2a. 60
Произведем вычисления:
| Па = 3,2 Па; -3 Дж = |
8-40- Ю-3
| 0,1 -3 Дж = 2,5-10 |
| 2,5 мДж. |
Л = 2.3,14-(0,1)2-40-10
Задачи для самостоятельного решения
1. Вычислить массу m атома азота. [2,33- Ю-26 кг]
2. Плотность газа р при давлении р = 96 кПа и температуре * = 0°С равна 1,35 г/л. Найти молярную массу М газа. [32-10~3 кг/моль]
3. Определить давления р\ и р2 газа, содержащего #= Ю9 молекул и имеющего объем V= 1 см3, при температурах Г, = ЗК и r2=1000K. [41,4 нПа; 13,8 мкПа]
4. При температуре /=35°С и давлении р = 708 кПа плотность некоторого газа р=12,2кг/м3. Определить относительную молекулярную массу Мг газа. [44,1]
5. Какой объем V занимает смесь азота массой mi = = 1 кг и гелия массой т2=1 кг при нормальных условиях? [6,4 м3]
6. В баллоне вместимостью У=15л находится смесь, содержащая mi = 10 г водорода, т2 = 54 г водяного пара и тз = 60г оксида углерода. Температура смеси /=27°. Определить давление. [1,69 МПа]
7. Найти полную кинетическую энергию, а также кинетическую энергию вращательного движения одной молекулы аммиака ЫНз при температуре t=27°C. [1,24-Ю-20 Дж; 6,2-10~21 Дж]
8. Определить удельные теплоемкости Cv и ср газообразного оксида углерода СО. [743 Дж/(кг-К); 1,04 кДж/(кг-К)1
9. Смесь газа состоит из кислорода 02 с массовой долей ш>1 = 85% и озона Оз с массовой долей ш2= 15%. Определить удельные теплоемкости cv и ср этой газовой смеси. [629 Дж/(кг-К); 877 Дж/(кг-К)]
10. Газовая смесь состоит из азота массой mi = Зкг и водяного пара массой т2=1 кг. Принимая эти газы за идеальные, определить удельные теплоемкости cv и ср газовой смеси. [902 Дж/(кг-К); 1,24 кДж/(кг-К)]
11. Молекула газа состоит из двух атомов; разность удельных теплоемкостеи газа при постоянном давлении и постоянном объеме равна 260 Дж/(кг>К). Найти молярную массу газа и его удельные теплоемкости Cv и ср. 132- Ю-3 кг/моль; 650 Дж/(кг-К); 910 Дж/(кг-К)]
 дельными пластинками с площадью поверхности 5 = = 100 см2 каждая, расположенными на расстоянии / = = 20мкм друг от друга, заполнено водой. Определить силу F, прижимающую пластинки друг к другу. Считать мениск вогнутым с диаметром d, равным расстоянию между пластинками.
дельными пластинками с площадью поверхности 5 = = 100 см2 каждая, расположенными на расстоянии / = = 20мкм друг от друга, заполнено водой. Определить силу F, прижимающую пластинки друг к другу. Считать мениск вогнутым с диаметром d, равным расстоянию между пластинками.
276.Глицерин поднялся в капиллярной трубке диаметром канала d=l мм на высоту Л = 20 мм. Определить поверхностное натяжение а глицерина. Считать смачивание полным.
277. В воду опущена на очень малую глубину стеклянная трубка с диаметром канала d= 1 мм. Определить массу т воды, вошедшей в трубку.
278.На сколько давление р воздуха внутри мыльного пузыря больше нормального атмосферного давления р0, если диаметр пузыря d = 5 мм?
279.Воздушный пузырек диаметром d = 2,2 мкм находится в воде у самой ее поверхности. Определить плотность р воздуха в пузырьке, если воздух над поверхностью воды находится при нормальных условиях.
280. Две капли ртути радиусом г=1,2мм каждая слились в одну большую каплю. Определить энергию Е, которая выделится при этом слиянии. Считать процесс изотермическим.
|
из
5.00
|
Обсуждение в статье: Задачи для самостоятельного решения. 1.Точка движется по окружности радиусом /? |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

