 |
Главная |
Физические свойства аренов
|
из
5.00
|
Арены избирательно растворяются в большинстве полярных растворителей. Температура кристаллизации у аренов тем выше, чем более симметрична его молекула, чем компактнее они упакованы в кристалллической решетке. Поэтому температура плавления у бензола на 100 оС выше, чем у толуола (+5,5 и – 95 оС соответственно). По этой же причине температура плавления у п-ксилола на 61 оС выше, чем у о-ксилола, а у дурола – на 105 оС выше, чем у изодурола. Конденированные арены с линейно аннелированными кольцами (типа антрацена) имеют значительно более высокие температуры кристаллизации, чем ангулярные (типа фенантрена).
Температуры кипения изомерных аренов отличаются незначительно, что затрудняет их разделение.
Вязкость и плотность аренов возрастают с увеличением числа заместителей, а индекс вязкости снижается. Плотность полиметилбензолов выше, чем у алкилбензолов с тем же числом атомов углерода, но с длинными заместителями.
Арены имеют высокую детонационную стойкость. Их октановое число выше 100, т. е. больше, чем у эталона – изооктана. Наличие метильных заместителей в о-положении снижает детонационную стойкость, а в м- и п- положениях – повышает.
Арены отличаются наименьшей воспламеняемостью, а следовательно, и низкими цетановыми числами. Не случайно цетановое число 1-метил- нафталина принято за 0 в шкале цетановых чисел. Поэтому арены крайне нежелательны в дизельных топливах.
Для аренов характерна совокупность ряда физических свойств и структурных особенностей:
а) характер связей С – С – промежуточный между простыми и двойными связями;
б) в голоядерных моноциклах все связи С – С равноценны;
в) плоское или почти плоское строение цикла;
г) поглощение света при сравнительно больших длинах волн;
д) легкая поляризуемость;
е) анизотропия диамагнитной восприимчивости.
Химические свойства
Арены характеризуются довольно высокой термодинамической устойчивостью, несколько уступающей алканам, но значительно превышающей алкены и циклоалкены. В большей мере это относится к незамещенным аренам, и аренам с меньшим количеством колец в молекуле. Особенно затруднены с аренами реакции присоединения.
6.3.1. Реакции электрофильного замещениядля aренов наиболее характерны. Механизм электрофильного замещения может быть представлен такой схемой:
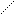





 Н Х
Н Х









 + Х+ Х+ + Н+. (6.1)
+ Х+ Х+ + Н+. (6.1)
 Х
Х
 -комплекс
-комплекс 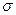 -комплекс
-комплекс
где Х+ – электрофил.
Электрофильному замещению предшествует кислотно-основная реакция, например:
 НNO3 +2H2SO4 2HSO4 - +H3O+ + NO-2; (6.2)
НNO3 +2H2SO4 2HSO4 - +H3O+ + NO-2; (6.2)

 2Н2SO4 SO3 + H3O+ + HSO4 – ; (6.3)
2Н2SO4 SO3 + H3O+ + HSO4 – ; (6.3)

 SO3 + H2SO4 HSO4- + SO3H+ (6.4)
SO3 + H2SO4 HSO4- + SO3H+ (6.4)
При галогенировании в присутствии сильных или льюисовских кислот (FeCl3, AlCl3, SnCl4 и т. д.) происходит образование ионов:
 Сl2 + H2SO4 Cl+ + HCl + HSO4- ; (6.5)
Сl2 + H2SO4 Cl+ + HCl + HSO4- ; (6.5)

 Cl2 + FeCl3 Cl
Cl2 + FeCl3 Cl  + + FeCl4- . (6.6)
+ + FeCl4- . (6.6)
При повторном замещении образуются м-замещенные соединения.
6.3.2. Реакции присоединения. Эти реакции не являются характерными для аренов и протекают в жестких условиях при избыточном давлении и в присутствии катализатора (Ni, Pt, Pd и др.):




 + 3Н2 . (6.7)
+ 3Н2 . (6.7)
Другая реакция присоединения – галогенирование – протекает по свободно-радикальному механизму в жидкой фазе при фото- или другом виде инициирования:

 С6Н6 + 3Сl2 C6H6Cl6 . (6.8)
С6Н6 + 3Сl2 C6H6Cl6 . (6.8)
Еще одна реакция присоединения – озонирование:


 О3 СНО
О3 СНО


 3Н2 3 + 6Н2О. (6.9)
3Н2 3 + 6Н2О. (6.9)

 + 3О3 СНО
+ 3О3 СНО
 О3 О3
О3 О3
триозонид глиоксаль
Конденсированные арены вследствие неравноценности связей С – С более реакционноспособны, чем бензол, и в реакции присоединения вступают с большей скоростью:



 ОНС СНО СНО
ОНС СНО СНО








 2О3 О3 +2Н2 + ; (6.10)
2О3 О3 +2Н2 + ; (6.10)



 СНО
СНО
–2Н2O
О3
 |








 Сl2 Cl Cl; (6.11)
Сl2 Cl Cl; (6.11)
 | |||
 | |||













 Cl2 . (6.12) Cl Cl
Cl2 . (6.12) Cl Cl
6.3.2. Восстановление с йодистым водородом. Эта реакция протекает по механизму гидроизомеризации:




 Т, 6НI СН3 + 3I2 . (6.13) метилциклопентан
Т, 6НI СН3 + 3I2 . (6.13) метилциклопентан
Окисление


 4О2, V2O5 CH – СООН
4О2, V2O5 CH – СООН

 + 2СО2 (6.14)
+ 2СО2 (6.14)
СН – СООН
малеиновая кислота
Гомологи бензола окисляются легче:






 СН3 + 2КМnO4 COOK+2MnO2 +KOH+H2O; (6.15)
СН3 + 2КМnO4 COOK+2MnO2 +KOH+H2O; (6.15)
 | |||
 | |||




 CH2-СН3 + 2КМnO4 COOK+2MnO2 +KOH+CH4+H2O; (6.16)
CH2-СН3 + 2КМnO4 COOK+2MnO2 +KOH+CH4+H2O; (6.16)
бензоат калия


 CH3 CH3 COOH
CH3 CH3 COOH


 3[O] 3[O]
3[O] 3[O]







 СН3 COOH COOH . (6.17)
СН3 COOH COOH . (6.17)
–H2O –H2O
 -метилбензойная фталевая кислота
-метилбензойная фталевая кислота
кислота
6.3.4. Алкилирование. Реакции алкилирования имеют важнейшее значение в органическом синтезе. С помощью этих реакций получают широкий ассортимент продуктов, таких как стирол и ά-метилстирол, изопропилбензол и ацетофенон, фенол и ацетон и т. д.
CH3 CH3




 AlCl3 2[O]
AlCl3 2[O]
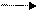










 + СН3 – СН = СН2 CH – CH3 C CH3 (6.18)
+ СН3 – СН = СН2 CH – CH3 C CH3 (6.18)
 |
 ZnO O – OH
ZnO O – OH



 C = CH2 – H2
C = CH2 – H2



 OH + CH3 – C – CH3
OH + CH3 – C – CH3

 CH3
CH3
ά-метилстирол фенол O
ацетон









 AlCl3 ZnO + СН2 = СН2 CH2 – CH3 CH=CH2 (6.19)
AlCl3 ZnO + СН2 = СН2 CH2 – CH3 CH=CH2 (6.19)
 – H2 стирол
– H2 стирол





 C – CH3 [O]
C – CH3 [O]
O
ацетофенон












 6.3.5. Реакции полициклических соединений 2[H] изомеризация (6.20) 1,2-дигидро- 1,4-дигидро-
6.3.5. Реакции полициклических соединений 2[H] изомеризация (6.20) 1,2-дигидро- 1,4-дигидро-

 нафталин нафталин
нафталин нафталин
 |










 Н2 тетралин Ni ; (6.21) 2H2 декалин
Н2 тетралин Ni ; (6.21) 2H2 декалин

















 О2 2O2 НООС СООН О О СО2 + ; (6.22)
О2 2O2 НООС СООН О О СО2 + ; (6.22)
1,4-нафто- фталевая кислота
хинон










 2[H] ; (6.23)
2[H] ; (6.23)













 3[O], Cr2O3 O O; (6.24)
3[O], Cr2O3 O O; (6.24)

 – H2O
– H2O
антрахинон
 | |||||
 | |||||
 | |||||












 Br2
Br2
Вr Br – HBr Br. (6.25)






9-бромантрацен
|
из
5.00
|
Обсуждение в статье: Физические свойства аренов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

