 |
Главная |
Строение молекулы аммиака
|
из
5.00
|
Валентная структура молекулы:

Пространственное строение: молекула аммиака имеет пирамидальное строение. В вершине пирамиды азот. В углах треугольника, лежащего в основании пирамиды, атомы водорода.

Перпендикуляр, опущенный из вершины пирамиды на основание - это вектор, показывающий, что молекула аммиака полярна (диполь). Электронная плотность смещена в сторону более электроотрицательного атома — азота. Поэтому он заряжается отрицательно.
Строение молекулы метанаCH(4)
В предельных углеводородах атомы углерода находятся в первом валентном состоянии (sp3-гибpидизaция). В этом случае, .как известно, все четыре гибридные орбитали в пространстве составляют геометрическую фигуру — тетраэдр (углы между осями связей С—Н равны 109° 28').

В молекуле метана химические связи атомов водорода с атомом углерода имеют ковалентный характер. Если перекрывающиеся попарно электронные облака при образовании связей обозначить двумя точками или валентной черточкой, строение метана можно выразить формулами:
 или
или 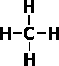
Неполярная и полярная ковалентные связи
При помощи химической связи атомы элементов в составе веществ удерживаются друг возле друга. Тип химической связи зависит от распределения в молекуле электронной плотности.
Химическая связь – взаимное сцепление атомов в молекуле и кристаллической решетке под воздействием электрических сил притяжения между атомами. Атом на внешнем энергетическом уровне способен содержать от одного до восьми электронов. Валентные электроны – электроны предвнешнего, внешнего электронных слоев, участвующие в химической связи. Валентность – свойство атомов элемента образовывать химическую связь.
Ковалентная связь образуется за счет общих электронных пар, возникающих на внешних и предвнешних подуровнях связываемых атомов.
Общая электронная пара осуществляется через обменный или донорно-акцепторный механизм. Обменный механизм образования ковалентной связи – спаривание двух неспа-ренных электронов, принадлежащих различным атомам. Донорно-акцепторный механизм образования ковалетной связи – образование связи за счет пары электронов одного атома (донора) и вакантной орбитали другого атома (акцептора).
Есть две основные разновидности ковалентной связи: неполярная и полярная.
Ковалентная неполярная связь возникает между атомами неметалла одного химического элемента (O2, N2, Cl2) – электронное облако связи, образованное общей парой электронов, распределяется в пространстве симметрично по отношению к ядрам обоих атомов.
|
из
5.00
|
Обсуждение в статье: Строение молекулы аммиака |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

